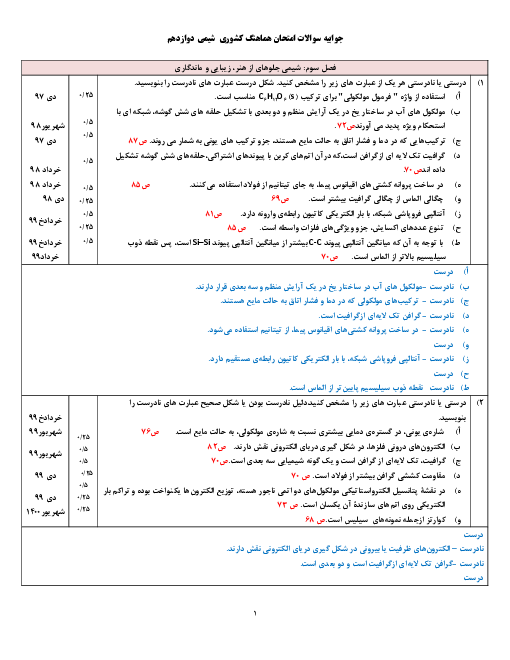
قسمت 4: سامانههای تعادلی و pH محلولها
شیمی (3)
دوازدهم
متوسطه دوم نظری
علوم ریاضی
درسنامه آموزشی این مبحث
ثابت یونش اسید HX، $4 \times {10^6}$ است در صورتی که غلظت تعادلی آن 0/04 مولار در محلول مورد نظر باشد، درجه یونش این اسید را محاسبه کنید (غلظت تعادلی و اولیه را برابر فرض کنید).
پاسخ تشریحی :
نمایش پاسخ
$[{H^ + }] = [{X^ - }]$
${K_a} = 4 \times {10^{ - 6}} \to 4 \times {10^{ - 6}} = \frac{{{{[{H^ + }]}^2}}}{{0/04}} \to {[{H^ + }]^2} = 16 \times {10^{ - 8}}$
$ \to [{H^ + }] = 4 \times {10^{ - 4}}mol{L^{ - 1}}$
$\alpha = \frac{{4 \times {{10}^{ - 4}}}}{{0/04}} = 1 \times {10^{ - 2}}$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!
محتواهای آموزشی مشابه
فایل های پاورپوینت، ویدئو، صوتی، متنی و ...
پرسش و پاسخ های مشابه
سوال کنید یا به سوالات دیگران پاسخ دهید ...