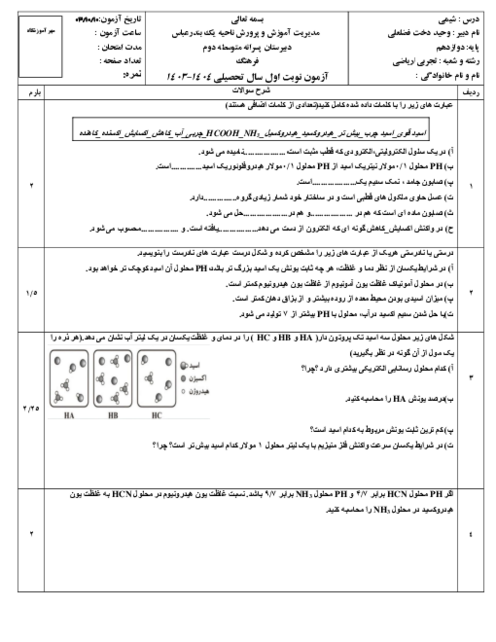
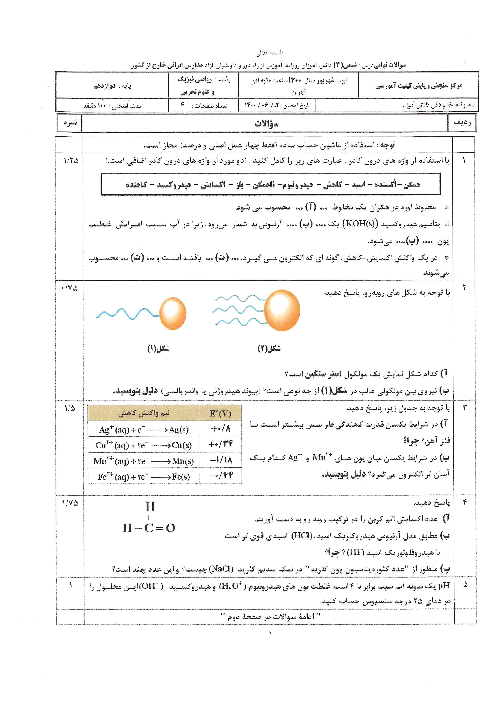
$HA$ یک اسید ضعیف است، این اسید به طور جزئی در آب به ${{A}^{-}},{{H}_{3}}{{O}^{+}}$ یونیده میشود. وقتی 1 مول $HA$ در مقدار کافی آب حل شود، مجموع ملکولهای $HA$ یونیده نشده و یونهای ${{A}^{-}},{{H}_{3}}{{O}^{+}}$ در محلول روی هم برابر 1/1 مول میشود. درصد تفکیک یونی $HA$ در شرایط داده شده، کدام است؟