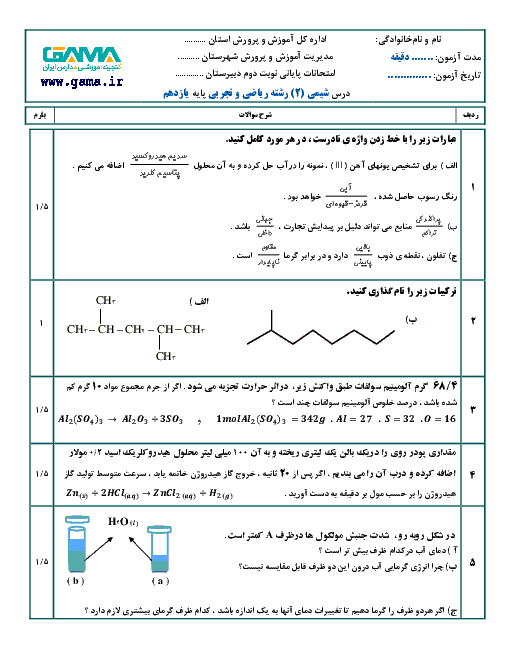
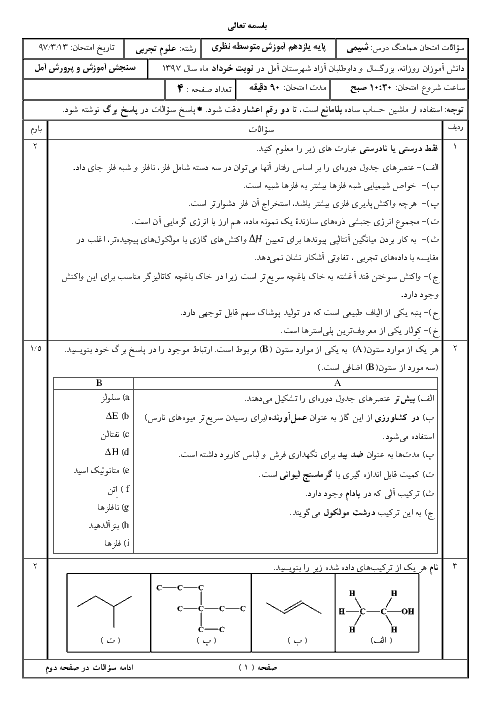
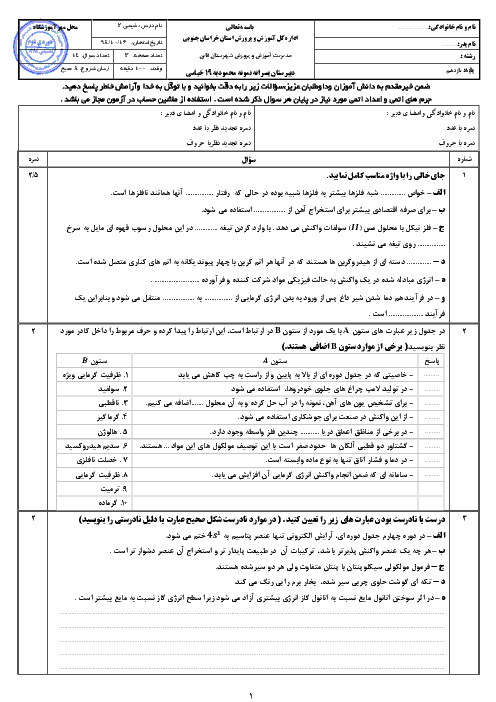
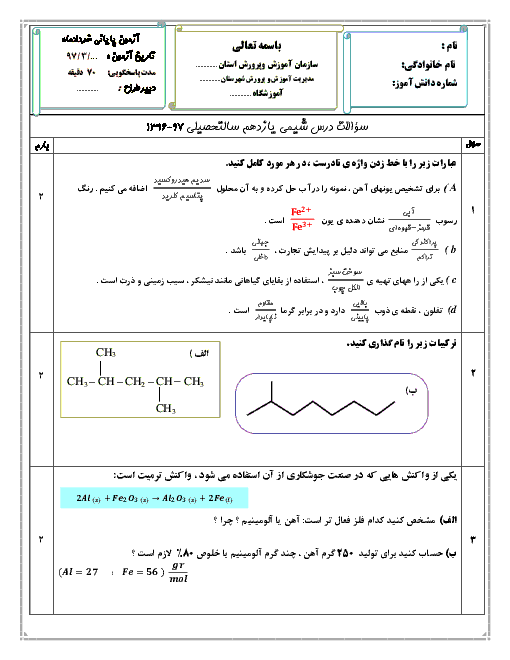
حل کاملاً استاندارد:
دادهها:
جرم نمونه سدیم هیدروژنکربنات = 2/1 گرم
خلوص = 80٪
اسید نیتریک کافی است (محدودکننده نیست)
اسید بر ناخالصی اثر ندارد
گام 1: محاسبه جرم خالص NaHCO₃
جرم خالص = 2/1 × 0/80
جرم خالص = 1/68 گرم
گام 2: محاسبه جرم مولی NaHCO₃
Na = 23
H = 1
C = 12
O₃ = 3 × 16 = 48
جرم مولی NaHCO₃ = 23 + 1 + 12 + 48 = 84 g/mol
گام 3: محاسبه تعداد مول NaHCO₃
n = 1/68 ÷ 84
n = 0/02 mol
گام 4: نسبت استوکیومتری واکنش
NaHCO₃ + HNO₃ → NaNO₃ + H₂O + CO₂
نسبت مولی NaHCO₃ به NaNO₃ برابر 1 به 1 است، بنابراین:
تعداد مول سدیم نیترات تولیدشده = 0/02 مول
نتیجه نهایی:
0/02 مول سدیم نیترات تشکیل میشود.