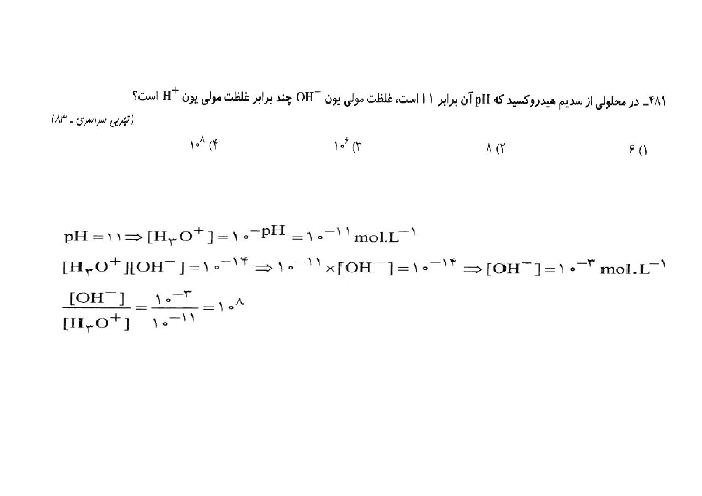$\begin{aligned} & ? \mathrm{~mol} \mathrm{HCl}=11,2 \mathrm{~L} \mathrm{HCl} \times \frac{1 \mathrm{~mol} \mathrm{HCl}}{22,4 \mathrm{~L} \mathrm{HCl}}=0,5 \mathrm{~mol} \mathrm{HCl} \\ & M=\frac{n}{V}=\frac{0,5 \mathrm{~mol}}{2 L}=0,25 \mathrm{~mol} \cdot \mathrm{~L}^{-1}=2,5 \times 10^{-1} \mathrm{~mol} \cdot \mathrm{~L}^{-1}=\left[\mathrm{H}^{+}\right] \\ & p H=-\log \left[\mathrm{H}^{+}\right] \Rightarrow p H=-\log \left(2,5 \times 10^{-1}\right) \Rightarrow p H=0,6 \\ & ? \mathrm{~mol} \mathrm{NaOH}=4 \mathrm{~g} \mathrm{NaOH} \times \frac{1 \mathrm{~mol} \mathrm{NaOH}}{40 \mathrm{~g} \mathrm{NaOH}}=0,1 \mathrm{~mol} \mathrm{NaOH} \\ & M=\frac{n}{V}=\frac{0,1 \mathrm{~mol}}{0,5 L}=0,2 \mathrm{~mol} \cdot \mathrm{~L}^{-1}=2 \times 10^{-1}=\left[\mathrm{OH}^{-}\right] \\ & \Rightarrow\left[\mathrm{H}_3 \mathrm{O}^{+}\right]=5 \times 10^{-14} \\ & p H=13,3 \\ & 13 / 3-0,6=12,7\end{aligned}$