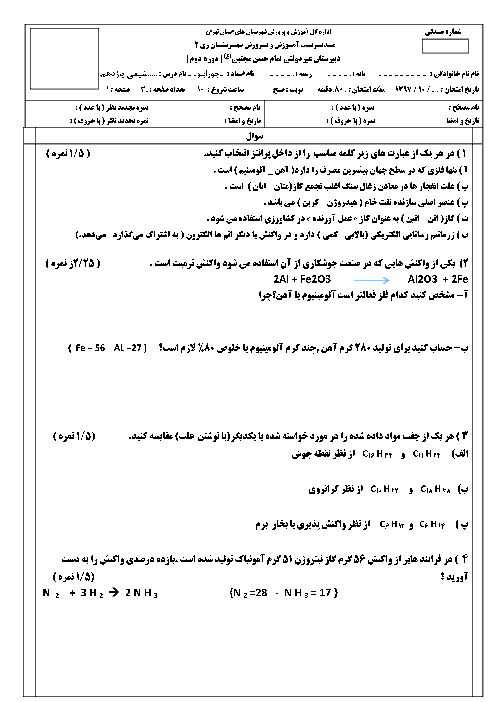
$\Delta H$به دست آمده برای واکنش زیر به کمک آنتالپی سوختن برابر ......... کیلوژول برمول است و میان دو روش آنتالپی پیوند و آنتالپی سوختن، گزارش $\Delta H$به روش ......... مناسبتر است.$\mathrm{C}_2 \mathrm{H}_4(\mathrm{~g})+\mathrm{H}_2(\mathrm{~g}) \rightarrow \mathrm{C}_2 \mathrm{H}_6(\mathrm{~g})$ (آنتالپی پیوندهای $C-C ، C=C \iota H-H$و $C-H$ به ترتیب برابر 436، 614، 348 و 415 کیلوژول بر مول و آنتالپی سوختن هیدروژن، اتن و اتان به ترتیب برابر 286- ، 1410- و 1560- کیلوژول بر مول است.)
136- ، آنتالپی سوختن
2 )
128- ، آنتالپی پیوند
3 )
136- ، آنتالپی پیوند
4 )
128- ، آنتالپی سوختن
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!