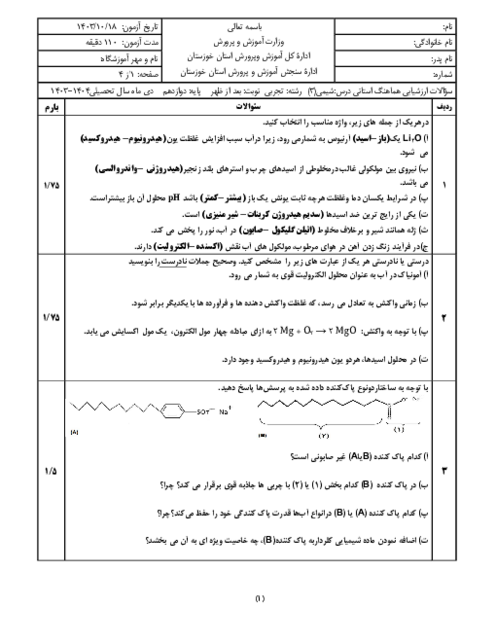
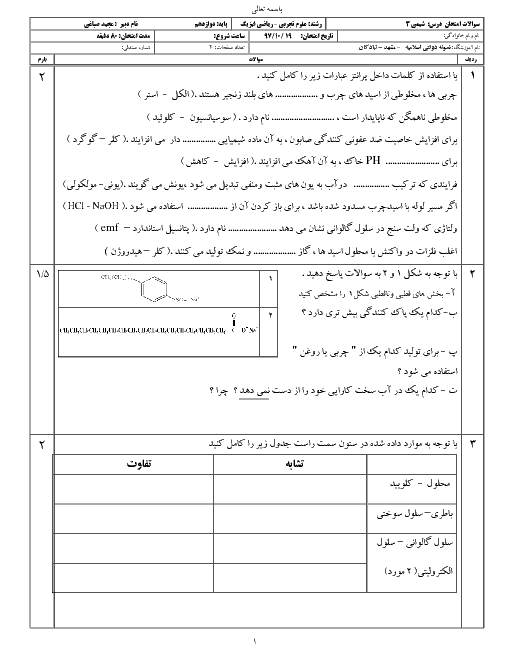
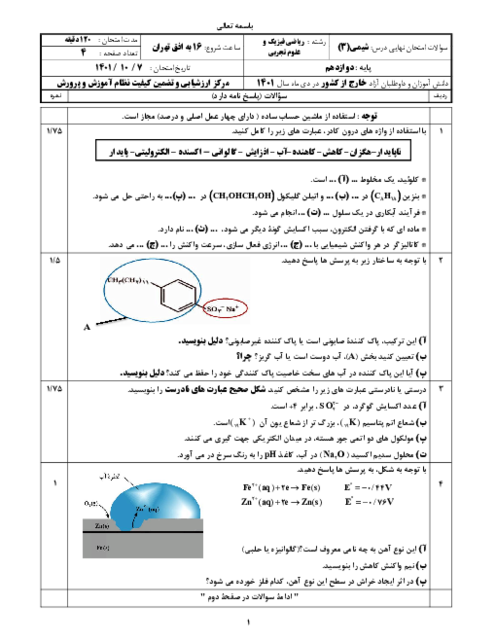
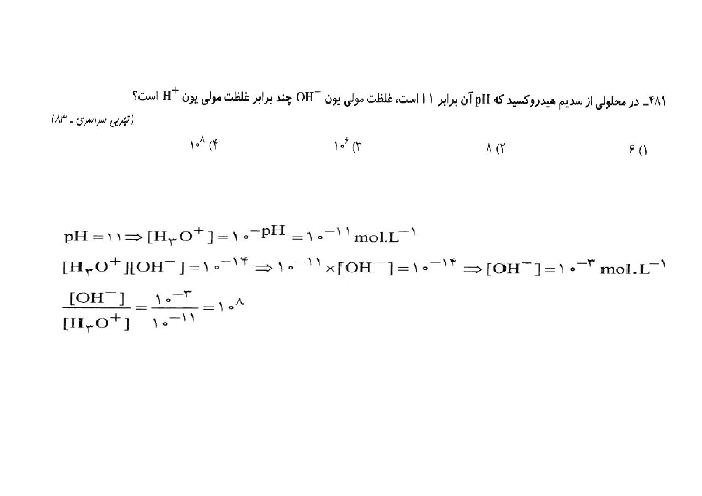اگر جرمهای برابر از دو اسید ضعیف HA و HB را در حجمهای برابر آب حل کنیم و pH دو محلول با هم برابر شود، با فرض آنکه جرم مولی HA دو برابر جرم مولی HB است، کدامیک از مطالب زیر بهدرستی بیان نشده است؟
1 )
قدرت اسیدی HA از HB بیشتر است.
2 )
درجۀ یونش اسید HA، دو برابر درجۀ یونش اسید HB است.
3 )
ثابت یونش اسید HA به تقریب 2 برابر ثابت یونش اسید HB است.
در شرایط یکسان، در واکنش با مقدار یکسان و کافی فلز روی، گاز هیدروژن تولید شده در واکنش با محلول HB بیشتر از محلول HA است.
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!