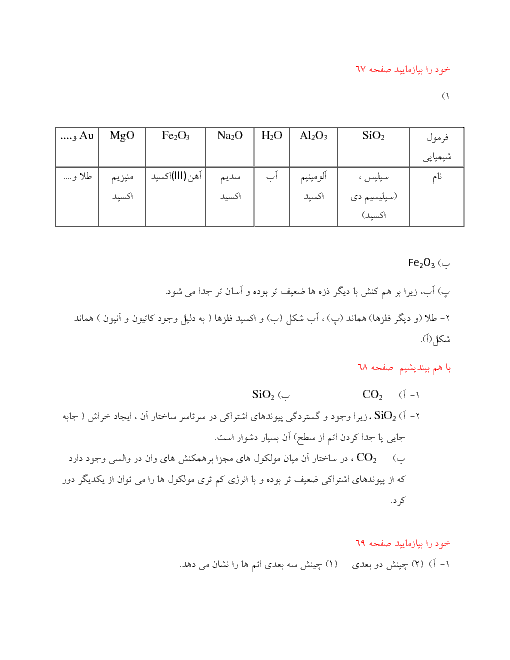
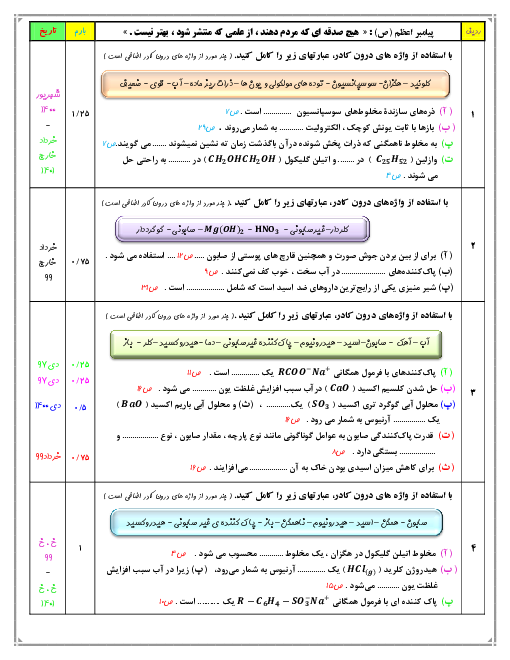
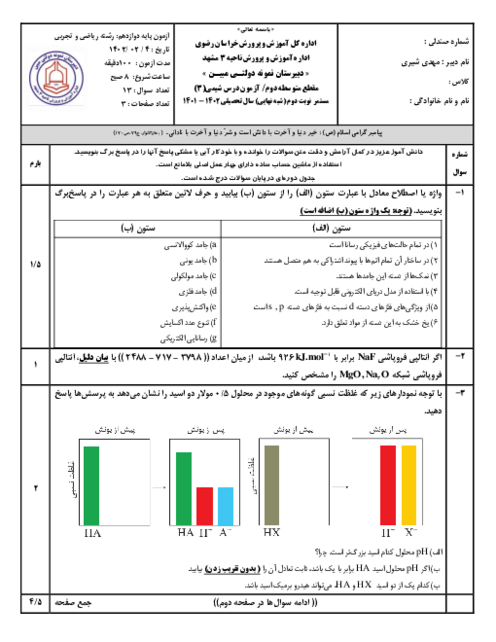
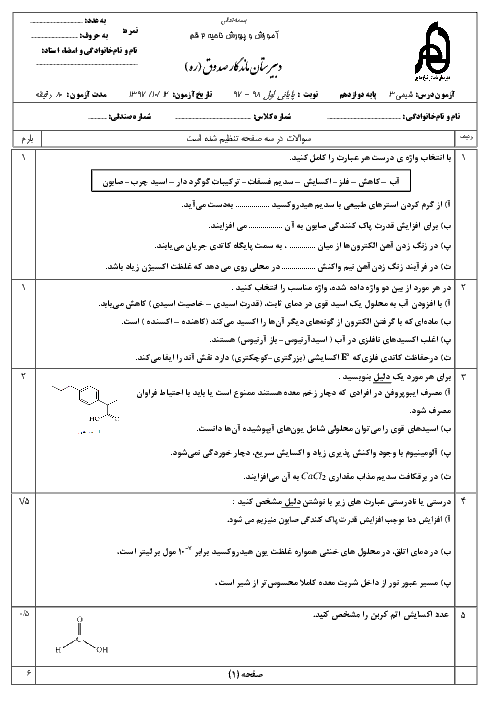
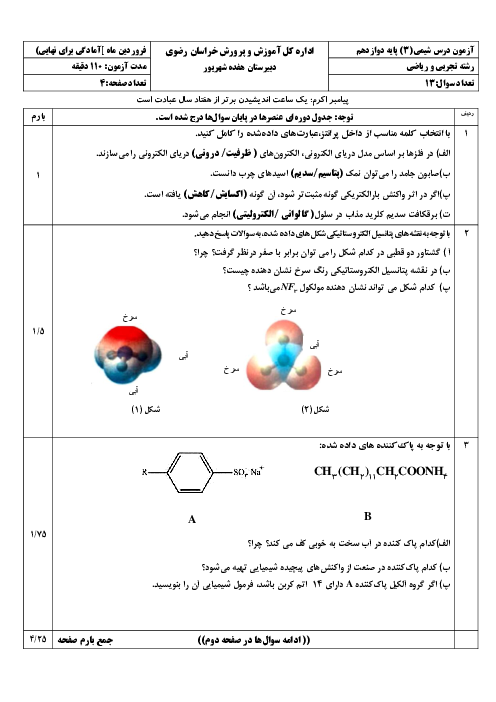
با قرار دادن فلز روی در محلول $HCI$ رفته رفته غلظت $Z{{n}^{2+}}$ زیاد میشود، ${{H}^{+}}$ الکترون گرفته و در نتیجه غلظت ${{H}^{+}}$ کم میشود. بنابراین غلظت $O{{H}^{-}}$ زیاد میشود، زیرا در دمای اتاق $\left[ {{H}^{+}} \right]\times \left[ O{{H}^{-}} \right]={{10}^{-14}}$ است.
چون غلظت ${{H}^{+}}$ کم میشود، بنابراین $PH$ افزایش مییابد.
$Zn\left( s \right)+2HCI\left( aq \right)\to ZnC{{I}_{2}}\left( aq \right)+{{H}_{2}}\left( g \right)$
$Zn\left( s \right)+\underbrace{2{{H}^{+}}\left( aq \right)+2C{{I}^{-}}\left( aq \right)}_{4mol}\to \underbrace{Z{{n}^{2+}}\left( aq \right)+2C{{I}^{-}}\left( aq \right)}_{3mol}+{{H}_{2}}\left( g \right)$
چون غلظت يونها كم میشود، رسانايی محلول كاهش میيابد.