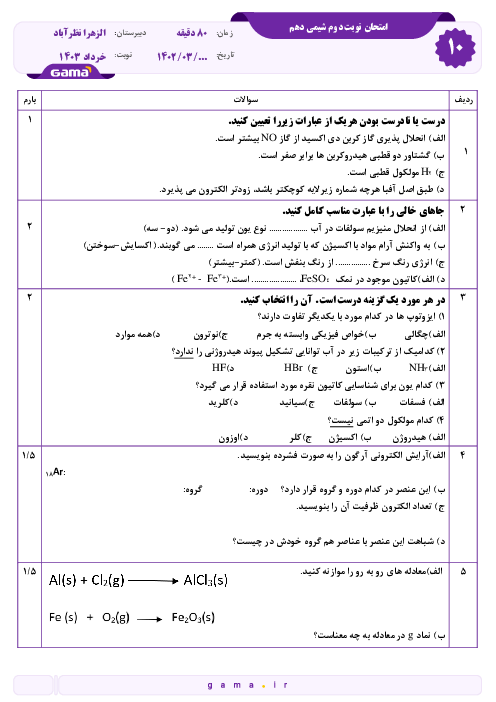
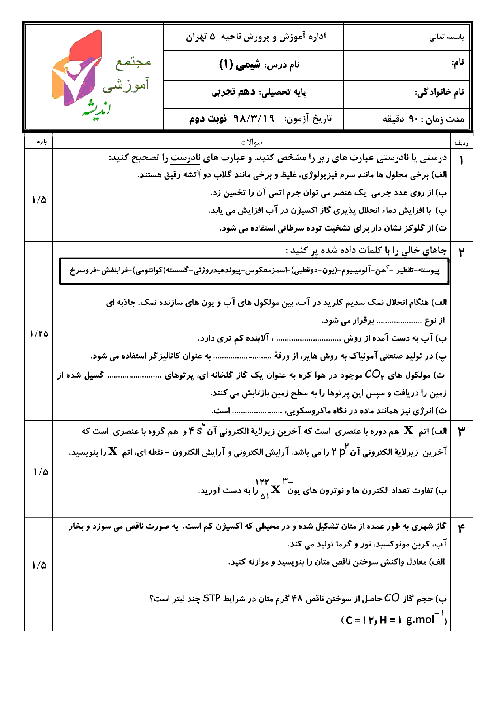
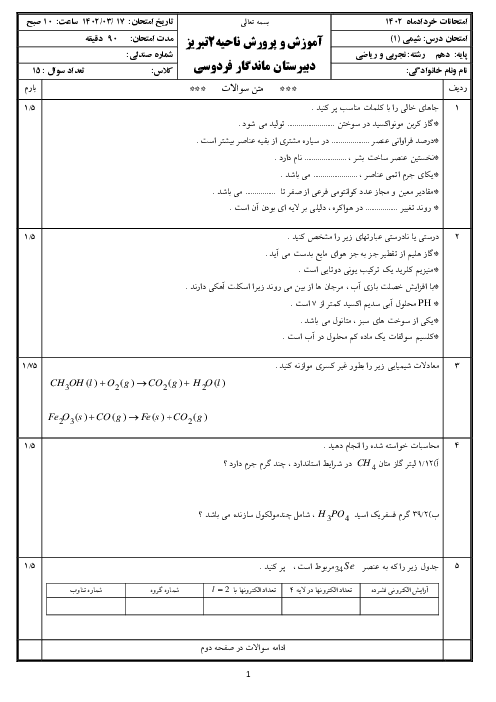
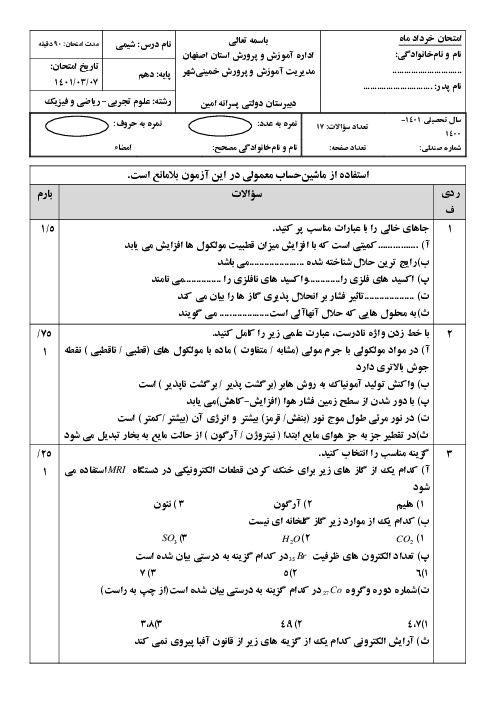
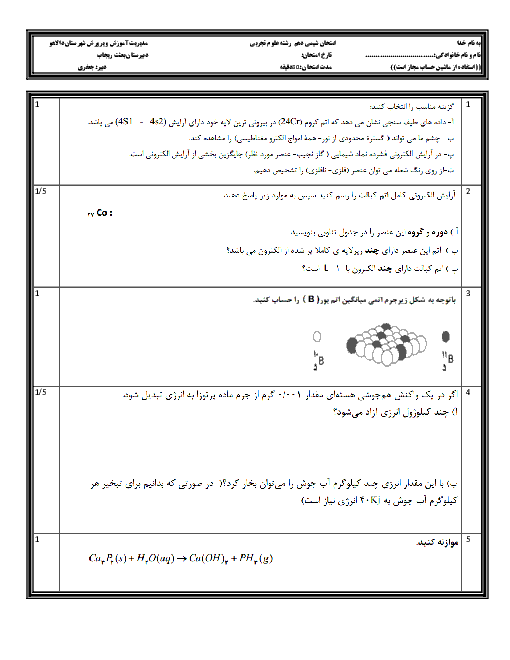
میخواهیم 100 کیلوگرم آهن را ذوب کنیم. برای اینکار از انرژی آزاد شده از واکنش $8{ }_1^1 H+8{ }_0^1 n \rightarrow{ }_8^{16} O$ استفاده میکنیم که کاهش جرم آن برابر با $1 / 2 \times 10^{-4} g$است. در این صورت چند گرم اتم اکسیژن تولید میشود؟ (انرژی لازم برای ذوب کردن هر گرم آهن برابر 243 ژول است.) $\left(c=3 \times 10^8 m \cdot s ^{-1}, 0=16 g \cdot mol ^{-1}\right)$
$3 / 6 \times 10^{-2}$
2 )
$7 / 2 \times 10^{-5}$
3 )
$3 / 6 \times 10^{-5}$
4 )
$7 / 2 \times 10^{-3}$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!