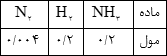مولهای گونههای شرکت کننده در تعادل: $2N{H_3}(g)\;\; \rightleftharpoons \;\;{N_2}(g) + 3{H_2}(g)$، در دمای معین و در محفظهای به حجم یک لیتر در جدول داده شده است:
الف) با نوشتن عبارت ثابت تعادل، مقدار عددی آن را در این دما محاسبه کنید.
ب) اگر 0/3 مول آمونیاک به تعادل بالا اضافه شود، مولهای ${N_2}(g)$ در تعادل جدید، چه تغییری میکند (افزایش یا کاهش)؟ توضیح دهید.