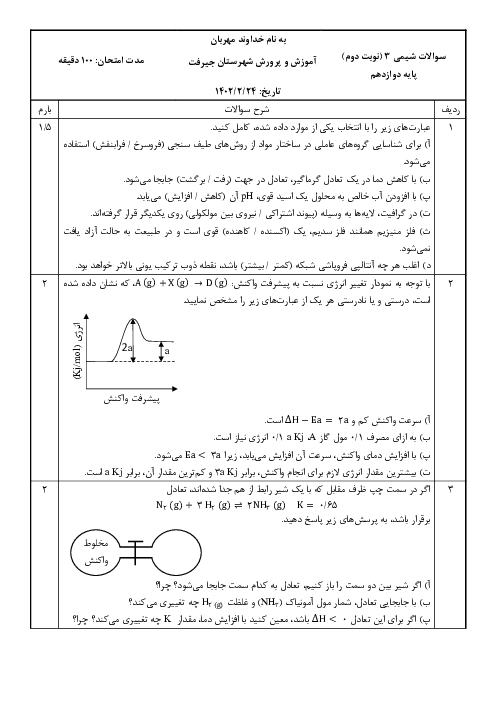
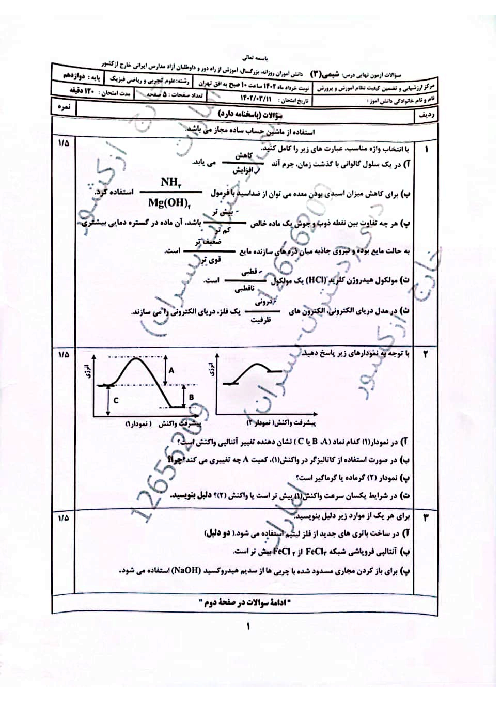
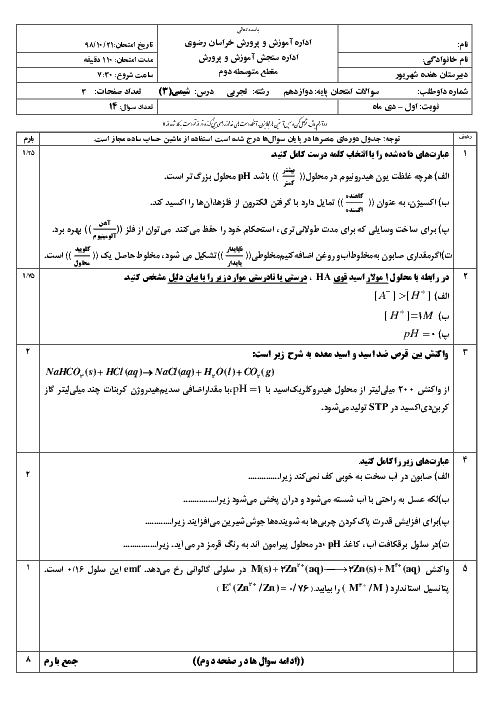
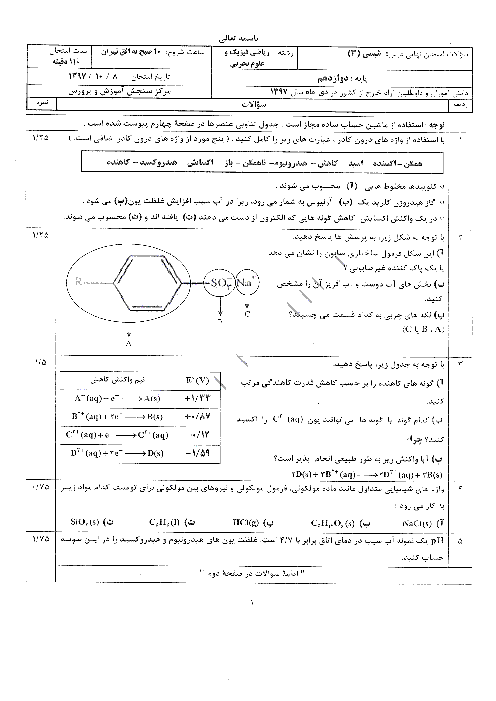
$11/2mlHCl\times \frac{1molHCl}{22400mlHCl}=0/0005molH\left[ HCl \right]=\frac{0/0005mol}{0/025L}=0/02mol.{{L}^{-1}}$
هیدروژن کلریداسیدی قوی است و به طور کامل در آب یونیده میشود، پس $\left[ {{H}_{3}}{{O}^{+}} \right]$ با $\left[ HCl \right]$ اولیه برابر است.
$\left[ {{H}_{3}}{{O}^{+}} \right]=\left[ HCl \right]=0/02mol.{{L}^{-1}}$
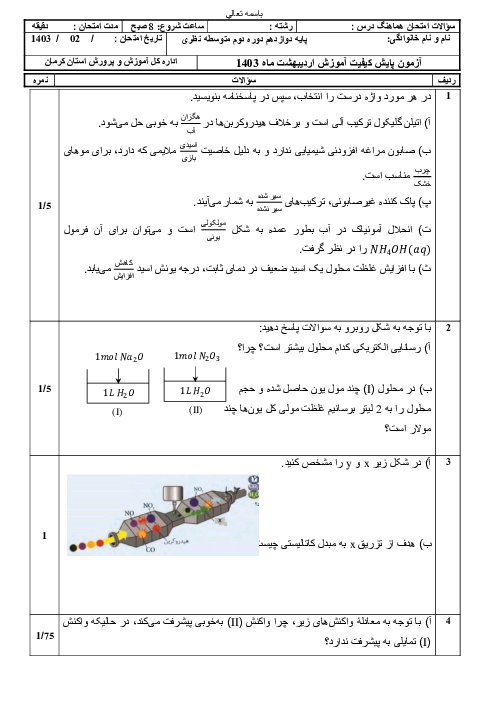
$PH=-\log \left[ {{H}_{3}}{{O}^{+}} \right]=-\log 2\times {{10}^{-2}}=-\log 2\times {{10}^{-2}}=-\log 2+2\log 10=-0/3+2=1/7$
$2HCl(aq)+CaC{{O}_{3}}(s)\to CaC{{l}_{2}}(aq)+{{H}_{2}}C{{O}_{3}}(aq)({{H}_{2}}O)(l)+C{{O}_{2}}(g))$
$?mgCaC{{O}_{3}}=1mLHCl\times \frac{1LHCl}{{{10}^{3}}mLHCl}\times \frac{0/02molHCl}{1LHCl}\times \frac{1molCaC{{O}_{3}}}{2molHCl}\times \frac{100gCaC{{O}_{3}}}{1molCaC{{O}_{3}}}\times \frac{1000mgCaC{{O}_{3}}}{1gCaC{{O}_{3}}}=1mgCaC{{O}_{3}}$