به محلول اسیدی به حجم 2 لیتر که غلظت یون هیدرونیوم در آن $0/1mol.{{L}^{-1}}$ است، $0/02$ مول از اسیدی ضعیف با ثابت یونش ${{10}^{-3}}$ اضافه میکنیم. غلظت اسید ضعیف پس از برقراری تعادل چند مولار میشود؟
1 )
$9/9\times {{10}^{-5}}$
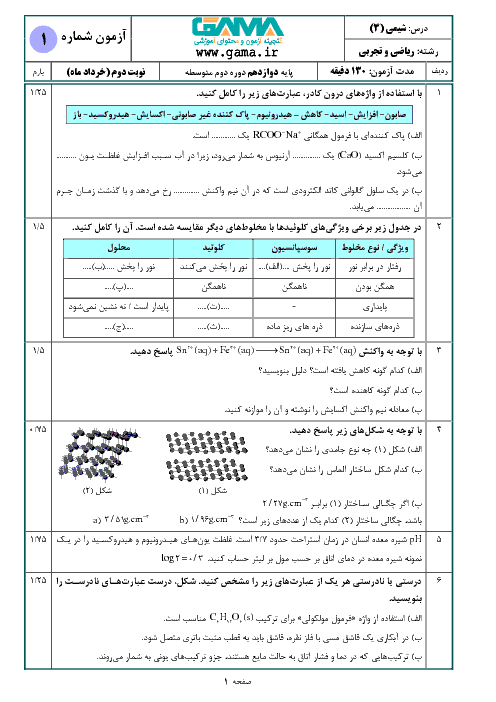
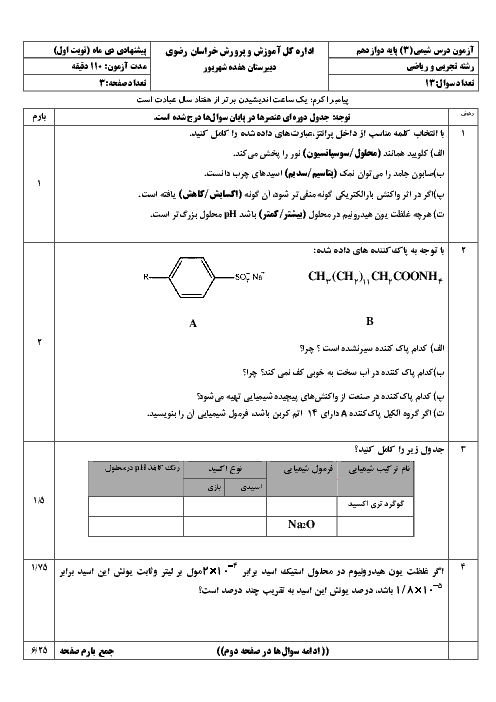
2 )
$2/7\times {{10}^{-3}}$
$9/9\times {{10}^{-3}}$
4 )
$7/3\times {{10}^{-3}}$