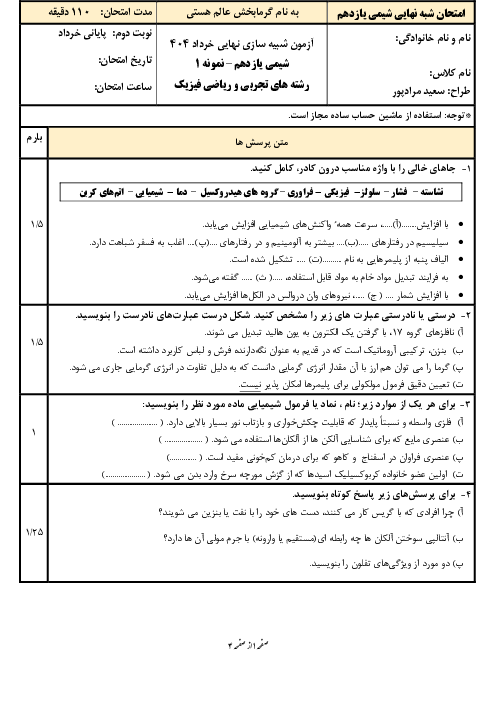
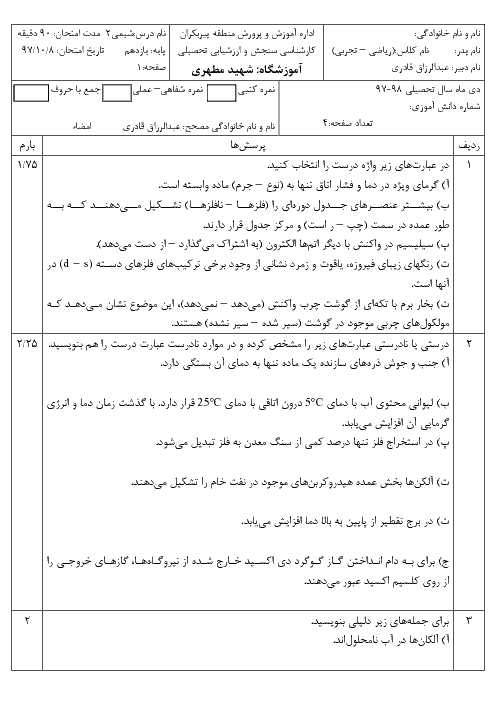
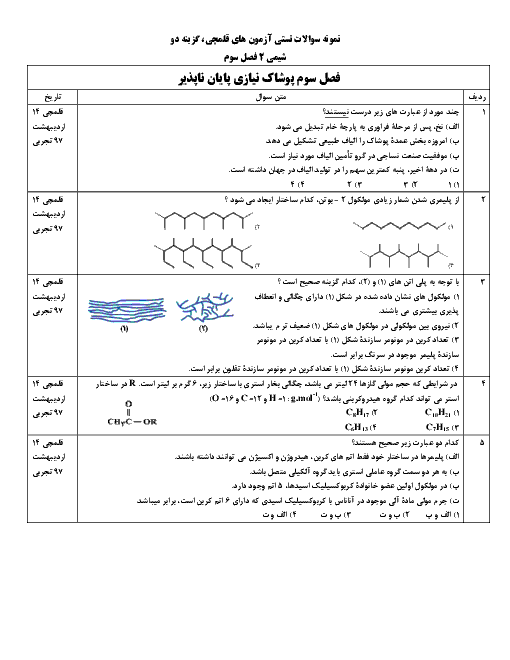
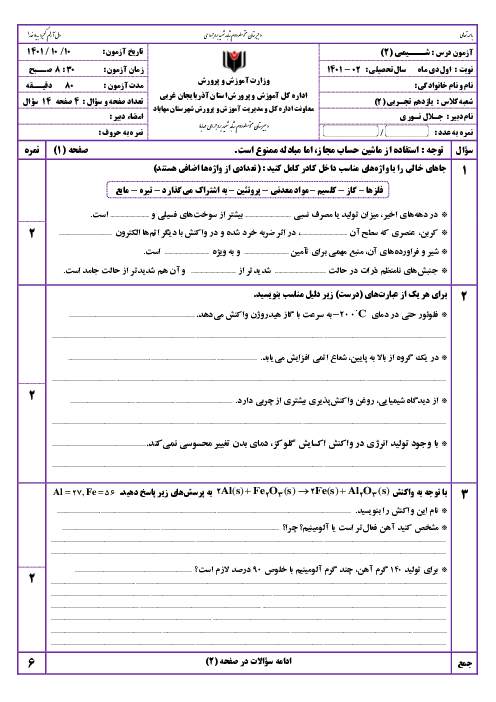
واکنش ترمیت را نوشته و با توجه به واکنشهای داده شده، آنتالپی آن را بهدست میآوریم:
$\mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{Al} \rightarrow \mathrm{Al}_2 \mathrm{O}_3+2 \mathrm{Fe}$: واکنش ترمیت
1) $4 \mathrm{Al}+3 \mathrm{O}_2 \rightarrow 2 \mathrm{Al}_2 \mathrm{O}_3 \quad \Delta \mathrm{H}_1=-3352 k \mathrm{~J}$
2) $4 \mathrm{Fe}+3 \mathrm{O}_2 \rightarrow 2 \mathrm{Fe}_2 \mathrm{O}_3 \quad \Delta \mathrm{H}=-1644 k \mathrm{~J}$
واکنش اول را بر 2 تقسیم میکنیم و واکنش دوم را نیز بر 2 تقسیم کرده و آن را معکوس مینماییم:
1) $2 \mathrm{Al}+\frac{3}{2} \mathrm{O}_2 \rightarrow \mathrm{Al}_2 \mathrm{O}_3 \quad \Delta \mathrm{H}_1=-1676 \mathrm{~kJ}$
2) $\mathrm{Fe}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{Fe}+\frac{3}{2} \mathrm{O}_2 \quad \Delta \mathrm{H}_1=+822 k \mathrm{~J}$
$\mathrm{Fe}_2 \mathrm{O}_3+2 \mathrm{Al} \rightarrow \mathrm{Al}_2 \mathrm{O}_3+2 \mathrm{Fe} \quad \Delta \mathrm{H}=822-1676=-854 \mathrm{~kJ}$
اکنون گرمای حاصل از مصرفشدن 5/4 گرم آلومینیم را برحسب ژول بهدست میآوریم:
$? J=5 / 4 g A l \times \frac{1 \text { molAl }}{27 \text { gAl }} \times \frac{854 \mathrm{~kJ}}{2 \text { molAl }} \times \frac{1000 \mathrm{~J}}{1 \mathrm{~kJ}}=85400 \mathrm{~J}$
اکنون تغییرات دمای 4/27 کیلوگرم آب (4270g) را پس از جذب این مقدار گرما بهدست میآوریم:
$\Delta \theta=\frac{\mathbb{Q}}{m \cdot c} \Rightarrow \Delta \theta=\frac{85400}{4270 \times 4} \Rightarrow \Delta \theta=5^{\circ} \mathrm{C}$
دمای اولیه آب برابر10درجه سانتی گراد بوده $\left(\theta_1=10^{\circ} \mathrm{C}\right)$و تغییرات دما برابر$5^{\circ} \mathrm{C}$ است. بنابراین دمای نهایی آب برابر $15^{\circ} \mathrm{C}$خواهد شد:
$\Delta \theta=\theta_2-\theta_1 \Rightarrow 5=\theta_2-10 \Rightarrow \theta_2=15^{\circ} \mathrm{C}$