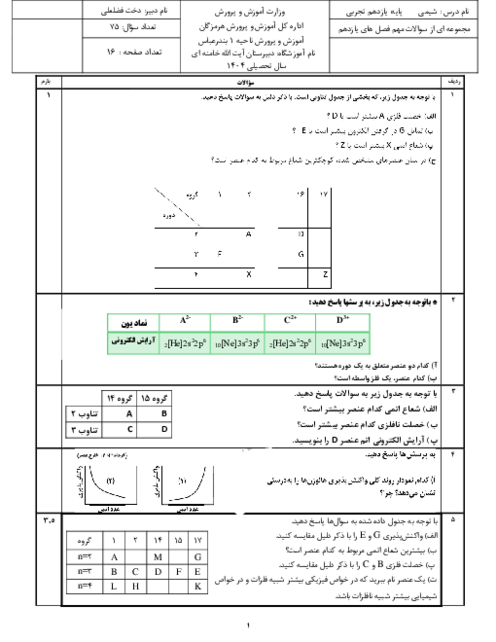
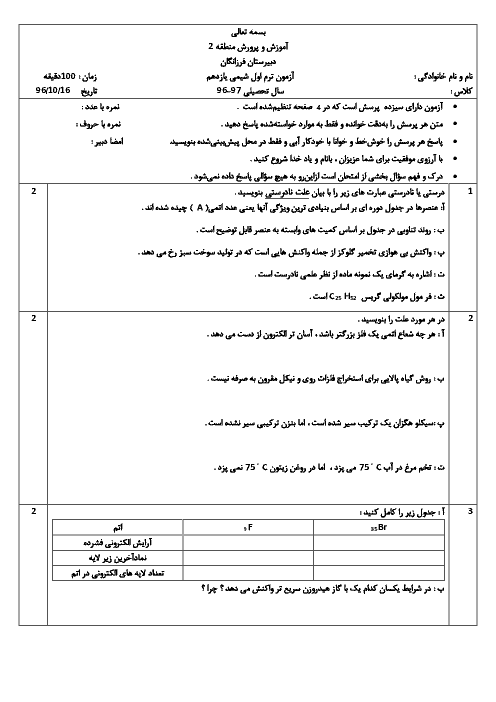
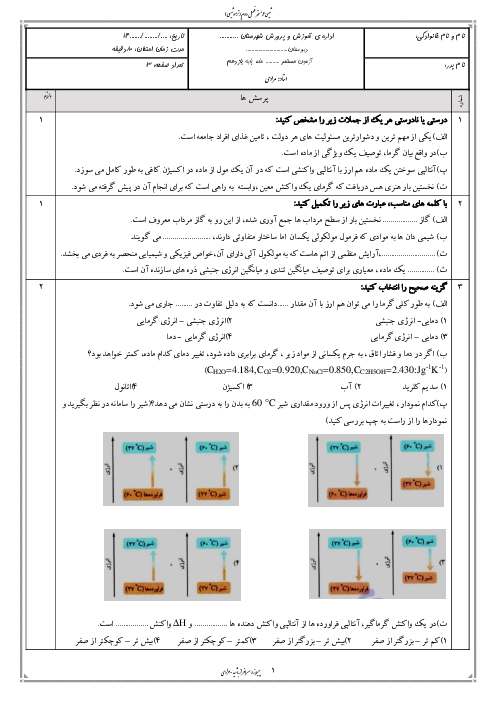
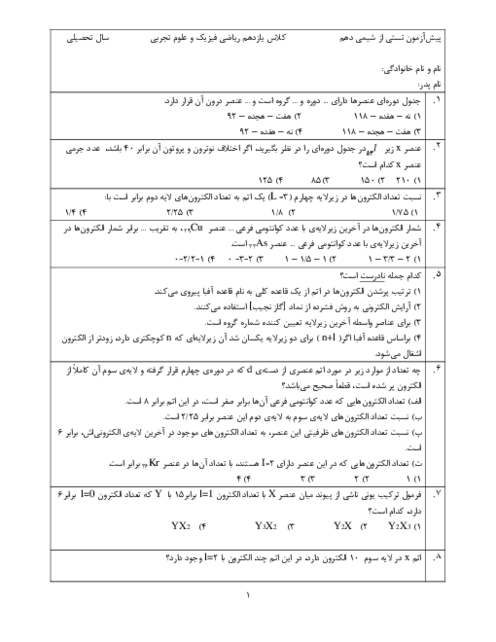
35 گرم $S{O_3}$ در یک کیلوگرم آب درون گرماسنج با دمای ${25^ \circ }C$ حل شده است و دمای آن به ${30^ \circ }C$ رسیده است. $\Delta H$ واکنش زیر تقریباً چند کیلوژول بر مول است؟ (از گرمای جذب شده توسط دیواره و حل شونده اولیه صرفنظر شود) $(C{H_2} = 4.2J.{g^{ - 1}}.{}^ \circ {C^{ - 1}},S = 32,O = 16:g.mo{l^{ - 1}})$
$S{O_3}(g) + {H_2}O(l) \to {H_2}S{O_4}(aq)$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!