قسمت 4: سامانههای تعادلی و pH محلولها
شیمی (3)
دوازدهم
متوسطه دوم نظری
علوم تجربی
درسنامه آموزشی این مبحث
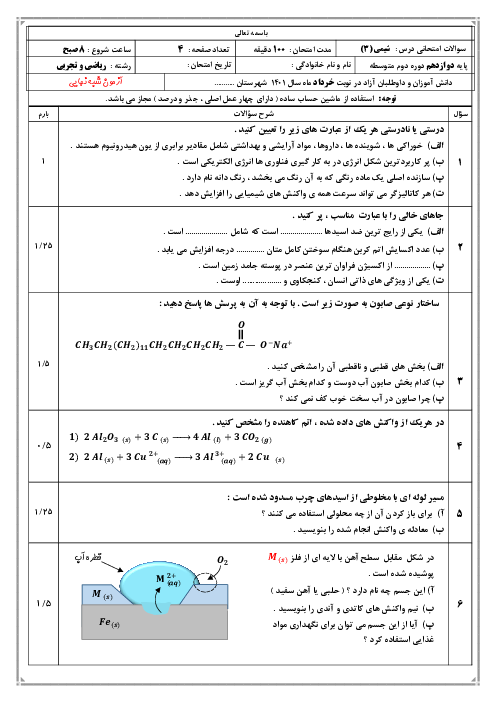
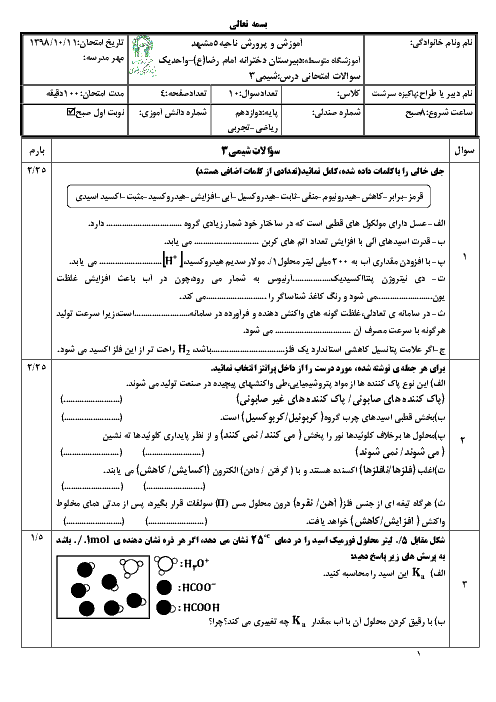
188 ميلیگرم پتاسيم اكسيد را در 200 ميلیليتر آب حل میكنيم. $pH$ محلول حاصل كدام است؟ (از تغيير حجم محلول صرفنظر شود.) $(K=39,O=16:g.mo{{l}^{-1}},\log 5=0/7)$