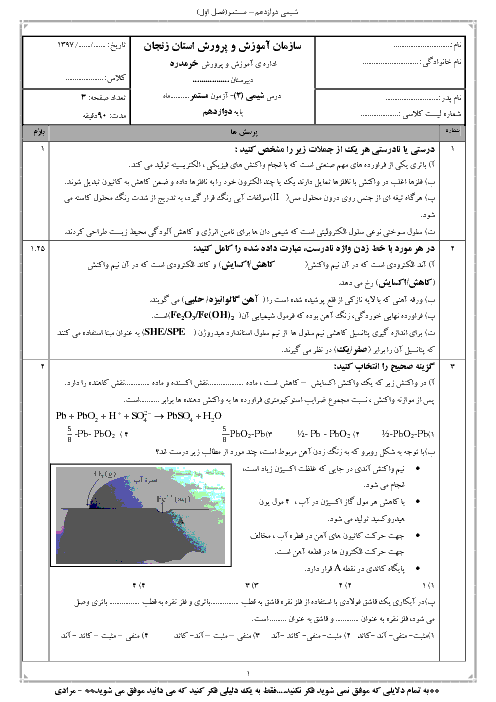
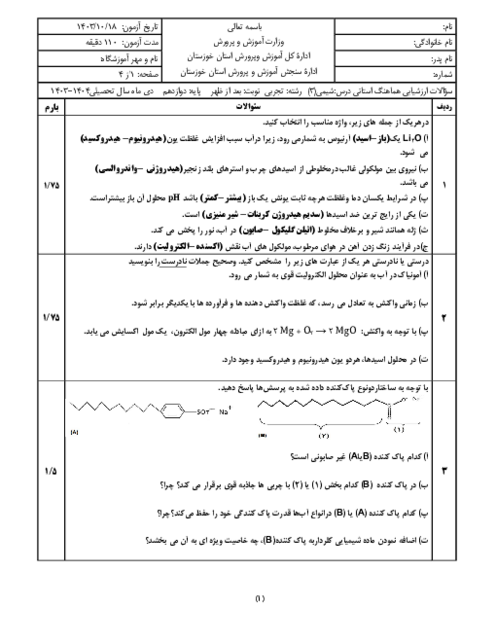
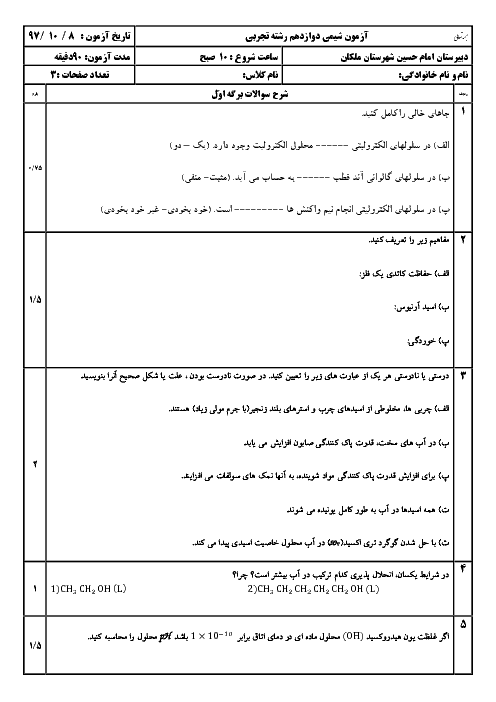
قسمت 2: تبدیل انرژی شیمیایی به الکتریکی
شیمی (3)
دوازدهم
متوسطه دوم نظری
علوم تجربی
درسنامه آموزشی این مبحث
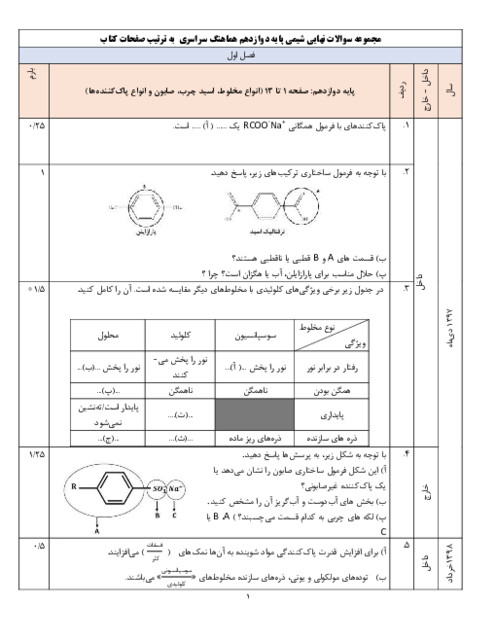
در صورتی که ولتاژ سلول $(Mn-Fe)$ برابر $0/74$ ولت و ولتاژ سلول $(Fe-Ag)$ برابر $1/24$ ولت باشد، ولتاژ سلول $(Mn-Ag)$ چند ولت است؟