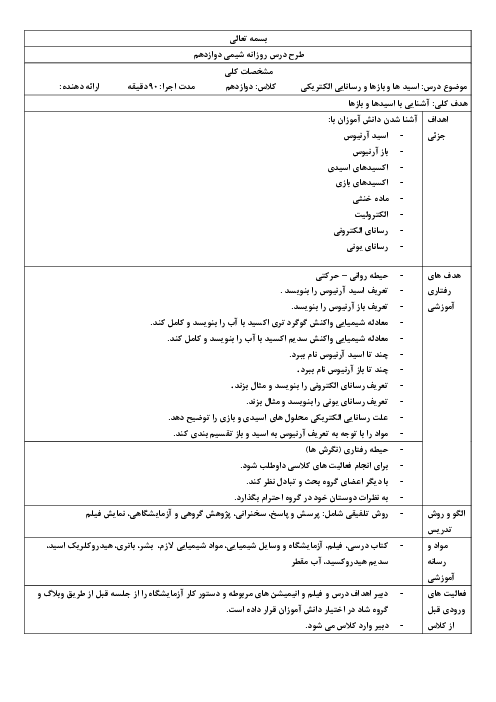
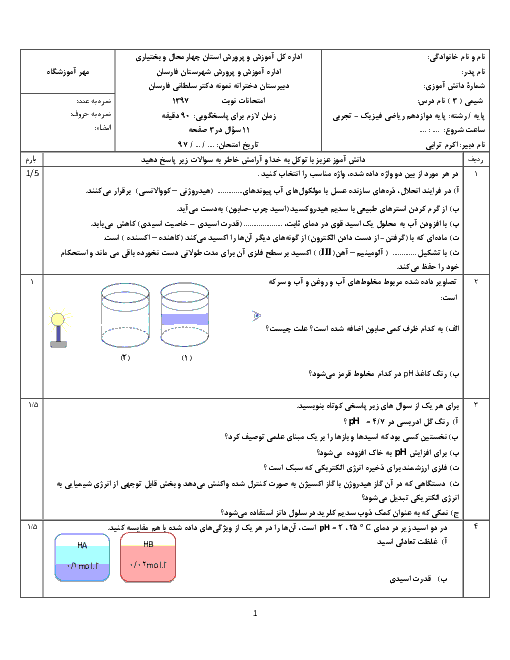
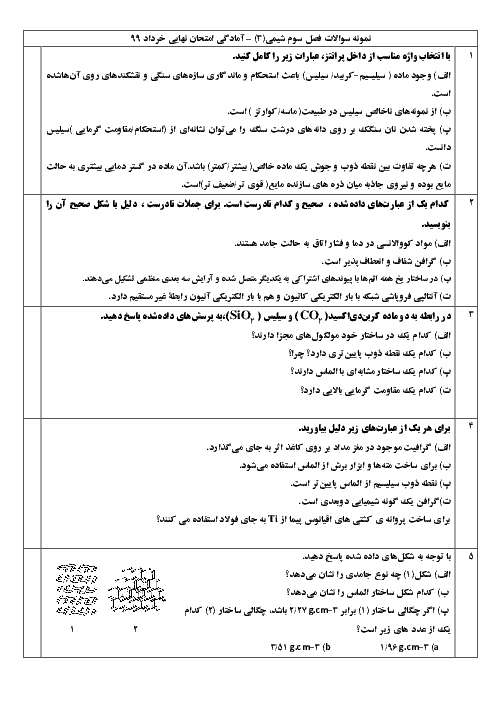
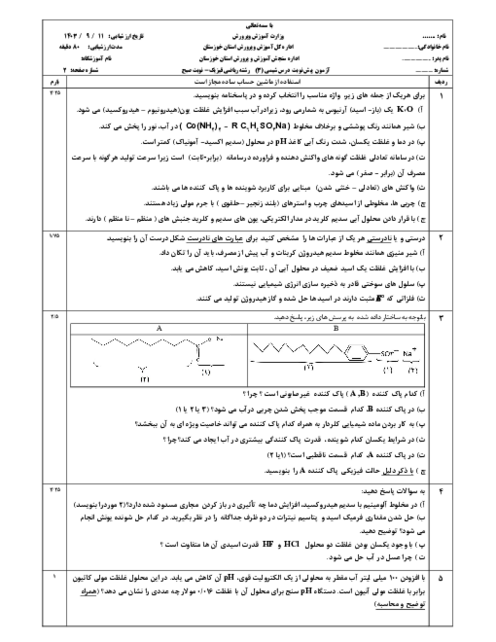
معادله واکنش داده شده زیر واکنش خنثی شدن اسید معده با ماده مؤثر یک ضد اسید را نشان میدهد. با توجه به آن به پرسشها پاسخ دهید. $(\log 3 = 0/48)$
$Al{(OH)_3}(s) + 3HCl(aq) \to AlC{l_3}(aq) + 3{H_2}O(l)$
الف) نام این ضد اسید را بنویسید.
ب) اگر pH اسید معده برابر 1/52 باشد، غلظت یون هیدرونیوم و غلظت این اسید را حساب کنید.
ج) 100 میلی لیتر هیدروکلریک اسید با غلظت 0/03 مولار با چند گرم از این ضد اسید خنثی میشود؟
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!