اگر در واکنش (موازنه نشده): $L{{i}_{3}}N(s)+{{H}_{2}}{\mathrm O}(I)\to Li{\mathrm O}H(aq)+N{{H}_{3}}(aq)$، $0/5$ مول لیتیم نیترید مصرف شود و بازده درصدی واکنش 80 درصد باشد، فراوردههای واكنش در مجموع با چند مول HCI واکنش کامل میدهند؟
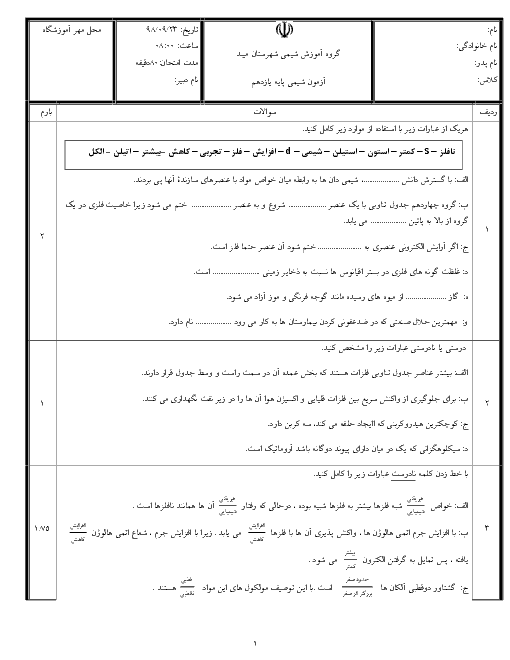
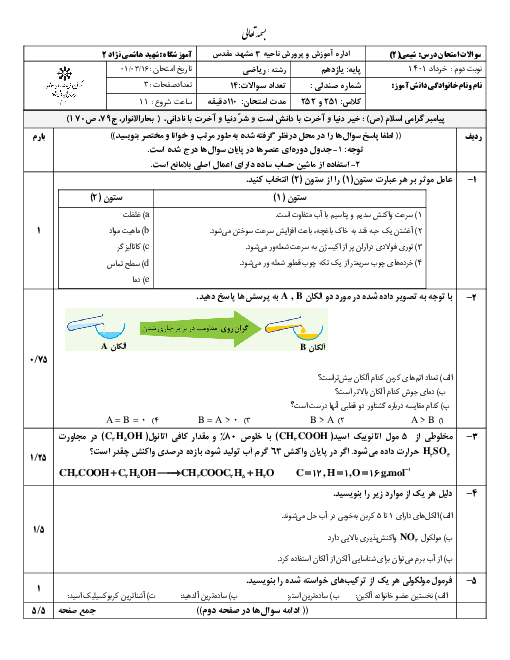
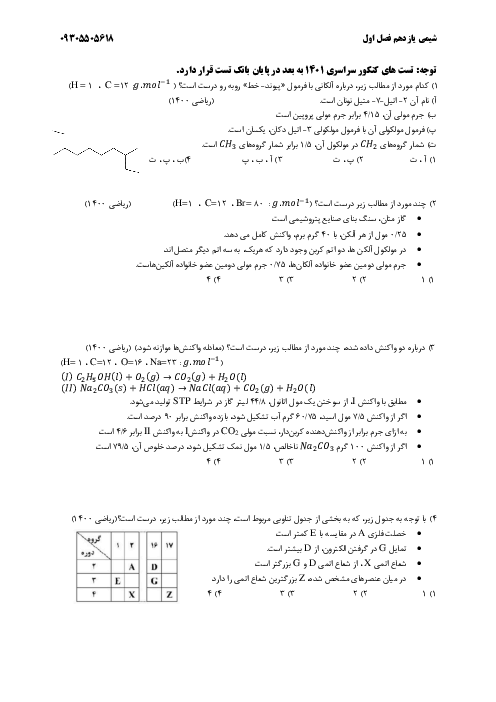
1) $Li{\mathrm O}H(aq)+HCI(aq)\to LiCI(aq)+{{H}_{2}}{\mathrm O}(I)$
2) $N{{H}_{3}}(aq)+HCI(aq)\to N{{H}_{4}}CI(aq)$