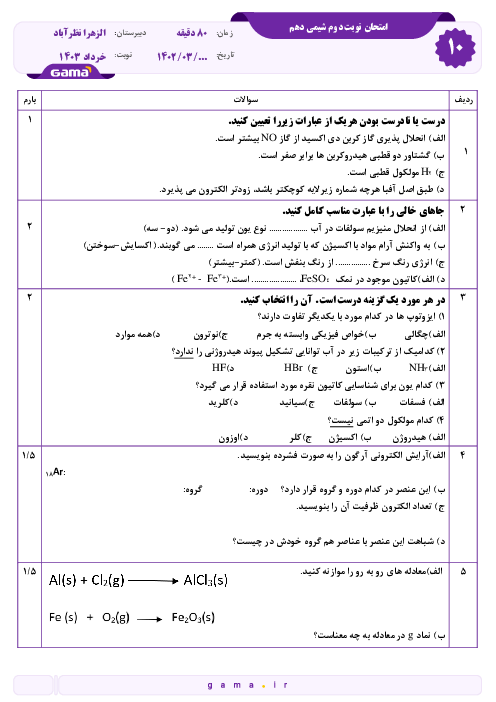
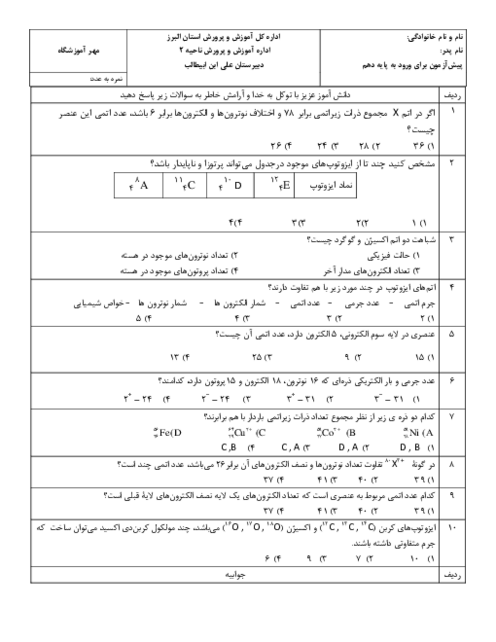
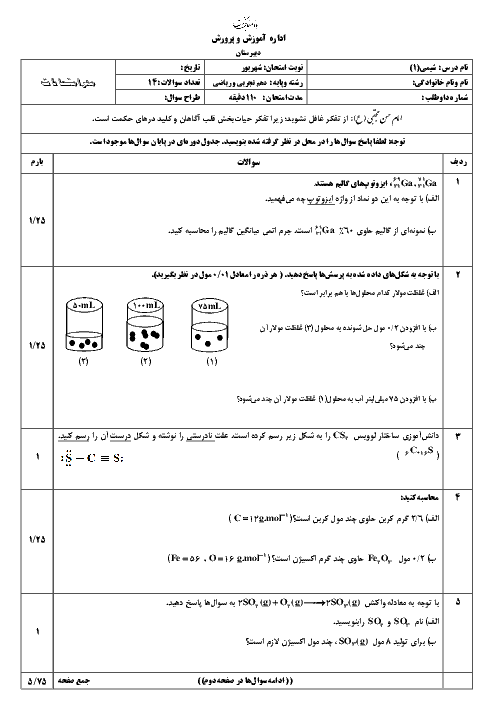
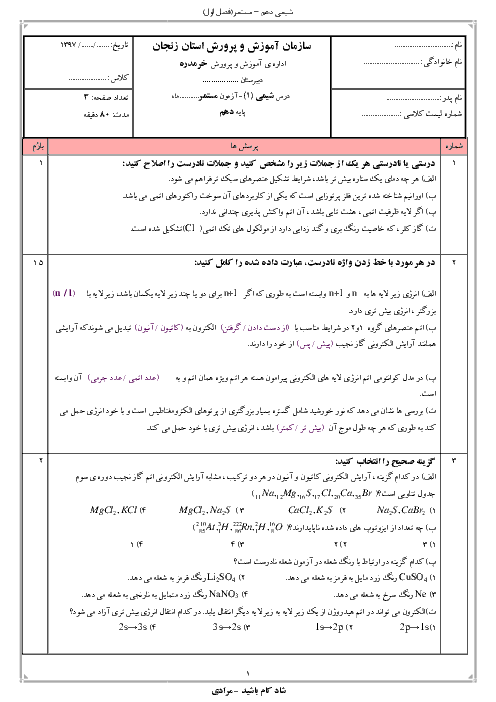
تحقيق در مورد افرادي كه براي دسته بندي عناصر تلاش كردند
به طور کلی، پیشرفت شیمی عمومی، از انتشار جدول طبقه بندی تناوبی عنصرها سرچشمه گرفت. با توجه به اینکه طبقه بندی در هر زمینه ای، مطالعه را آسان می کند، آنان که صاحب اندیشه ای در شیمی بودند، برای به نظم در آوردن و آسان کردن بررسی خواص عناصر، همواره فکر طبقه بندی آنها و احتمالاً کشف روابط و یا قوانین در این زمینه را در سر می پروراندند.
بدون شک لاووازیه نخشتین کسی بود که در این راه گام برداشت. او عناصر را به دو دسته ی کلی فلز و نافلز تقسیم کرد. او فلز را عنصری می دانست که در ترکیب با اکسیژن باز تولید می کند و غیر فلز را عنصری می دانست که د ر ترکیب با اکسیژن، اسید تولید می کند.
برسلیوس نیز مانند لاووازیه، عناصر را به دو دسته ی کلی فلز و نافلز تقسیم کرد. اما وی خواص الکتروشیمیایی عنصرها را در نظر گرفت. وی معتقد بود که فلز عنصری است که تمایل به از دست دادن الکترون و تشکیل یون مثبت دارد و غیر فلز عنصری است که تمایل به گرفتن الکترون و تشکیل آنیون دارد.
از سال 1871 به بعد، شیمیدانان برخلاف برسیلوس و لاووازیه که بر خواص شیمیایی عنصرها تاکید داشتند، در مسیر طبقه بندی بر اساس ارتباط بین جرم اتمی و خواص انها، کوششهایی به عمل آوردند و تلاش آنها در این راه کم و بیش با موفقیتهایی همراه بود.
تا سال 1872 شصتوسه عنصر شناخته شده بود و شیمیدانها به جستجوی راههایی برای مرتب كردن عنصرها پرداختند . این جستجو تا حدی شبیه تحقیق اولیه’ كپلر برای یافتن قاعدههایی بود كه حركات سیارههای منظومه’ شمسی را به هم مربوط میكند . علاوه بر جرمهای اتمی نسبی ، بسیاری از خواص دیگر عنصرها و مواد مركب حاصل از آنها تا آن زمان معین شده بود . بعضی از این خواص عبارت بودند از : نقطه’ ذوب ، نقطه’ جوش ، چگالی ، رسانایی الكتریكی ، رسانایی گرمایی ، سختی و ضریب شكست . نتیجه آنكه از سال 1870 به بعد، اطلاعات فراوانی درباره’ بسیاری از عنصرها و خواص آنها بدست آمده بود .
در سال 1829 شیمیدان آلمانی یوهان ولفگانگ دوبرینر مشاهده كرد كه عنصرها غالبا گروههایی از سه عنصر ، با خواص شیمیایی مشابه ، تشكیل میدهند . او تریادها ( به معنای سهتاییها ) را برای آنها پیشنهاد كرد و مانند (كلر ، برم و ید) ؛ ( كلسیم ، استرونسیم و باریم) و غیره . در هر تریاد جرم اتمی عنصر میانی تقریبا میانگین عددی جرمهای دو عنصر دیگر است . ولی بعدها معلوم شد كه همه’ این مطالب اهمیت چندانی ندارند .
دوشان کورتوآ دانشمند فرانسوی در سال 1862 طبقه بندی ویژه ای به نام پیچ تلوریک ارائه داد. او برای تنظیم جدول خود، استوانه ای در نظر گرفت و محیط ان را به 16 قسمت برابر تقسیم کرد. از هر کدام از انها خطی عمود بر قاعده ی استوانه عبور داد. سپس خطی با شیب 45 درجه از محل تقاطع یال اول با قاعده رسم کرد تا یالها را یکی پس از دیگری قطع کند. آنگاه عنصرهای شناخته شده تا ان زمان را به ترتیب جرم اتمی در محل تقاطع یالها با این خط شیب دار، قرار داد و مشاهده کرد که عناصری مه بر روی یک یال قرار می گیرند، جرم آنها به اندازه ی 16 واحد و یا مضربی از آن با یکدیگر تفاوت دارد ،خواص مشابهی خواند داشت. در این طبقه بندی تشابه خواص عنصرهای واقع بر یک یال، تا عنصر بیستم یعنی کلسیم رعایت می شد. مثلاً تیتان که در بالای اکسیژن و گوگرد قرار می گرفت، تشابعی با آنها نداشت.
ادلینگ دانشمند انگلیسی، در سال 1864 جدولی از عنصرها ، در 5 ستون و 15 سطر منظم کرد. او دریافته بود که با کنار گذاشتن هیدروزن، عناصر دیگر، به ترتیب صعودی جرم اتمی ، کنار یکدیگر قرار می گیرند . عناصر واقع در یک سطر، خواص مشابهی خواهند داشت.
در سال 1865 شیمیدان انگلیسی ج. ا. ر. نیولندز اعلام داشت كه عنصرها را میتوان به ترتیب افزایش جرم اتمی به دنبال هم نوشت . هنگامی كه اینكار انجام گرفت ، نظمی شگفتانگیز ایجاد شد : خواص شیمیایی و فیزیكی مشابه چند بار در فهرست ظاهر شد . نیولندز عقیده داشت كه ، در كل فهرست عنصرهایی با خواص مشابه به طور تناوبی ( یعنی در فاصلههایی منظم ) ظاهر میشوند. وی میگوید ْْ با شروع از یك عنصر معین ، هشتمین عنصر نوعی تكرار نخستین عنصر است ، همجون هشتمین نت در یك اكتاو موسیقی .ْْ البته نیولندز عناصر شناخته شده تا آن زمان را به ترتیب پشتسر هم در یك ستون چید ( و به صورت كنونی آنها را مرتب نكرد ) و متوجه شد كه در بعضی جاهها یك نظم وجود دارد . وی هیچ توجیهی برای فلزاتی كه الان فلزات واسطه مینامیم ، نداشت .
اما بعد از تشخیص وجود خانوادههایی با عناصر مشابه توسط نیولندز ، شیمیدانها كنجكاو شدند كه در جستجوی راهی اصولی برای تنظیم عنصرها برآیند ، به طوری كه اعضای یك خانواده با هم گروهبندی شوند . برای این منظور طرحهایی پیشنهاد شد كه موفقترین و مؤثرترین آنها طرح شیمیدان روسی د. ی مندلیف بود . مندلیف در سال 1871 به خصلت گسترده’ تناوبی در میان عنصرها پی برد. او راهی تازه برای مرتب كردن عنصرها در جدول ( به صورتی كه اكنون وجود دارد ) كشف كرد . گرچه خواص عنصرها با افزایش وزن اتمی به طور تناوبی تكرار میشود ، ولی نیولندز متوجه نشد كه جدایی عنصرهای مشابه برای عنصرهای سنگینتر در فهرست بزرگتر میشود و درنتیجه آنها را در گروه خود در نظر نگرفت . مندلیف نیز عنصرها را بر حسب افزایش وزن اتمی مرتب كرد به همین دلیل در جاهایی بینظمی مشاهده میشد و مندلیف حدس میزد كه شاید در تعیین وزن اتمی اشتباهی شده ، تا اینكه مدتی بعد دانشمند انگلیسی موزلی ، عدد اتمی را برای هر عنصر تعریف كرد و عناصر را بر طبق همان سبك مندلیف ، ولی اینبار بر حسب افزایش عدد اتمی مرتب كرد و به این ترتیب بینظمیها نیز برطرف شد و جدول كنونی به دست آمد .
اما جدول تناوبی دایرهای بعد از جدول تناوبی مندلیف و توسط دانشمندان زیادی به صورت متنوع و مختلف، ابداع و ارائه گردیده است.
از جمله اینها، دو جدول تناوبی حلقوی و حلزونی است كه توسط منوچهر ضیایی، ابداع شده است. این طرحهای آقای ضیاعی با الهام گرفتن از ساختمان كوچكترین واحد هر عنصر، یعنی اتمها و همچنین كره زمین و سایر كرات، مانند منظومه شمسی به صورت مدور تهیه شده است و خانههای جدول نه به صورت مربع (كه در جدول تناوبی مندلیف به چشم میخورد) بلكه به صورت دوایری است كه آرایش الكترونی هر عنصر را – هم به صورت دوایر بسیار كوچك و هم به وسیله اعداد در هر لایه – به صورت مداری نمایش میدهد.
در داخل این خانهها، عدد اتمی عناصر، نماد عنصر، حالت آنها در شرایط عادی (جامد، مایع و گاز) نشان داده شده است. عناصر رادیواكتیو نیز با علامت ویژه مشخص شدهاند.
در طرح حلقوی، هفت حلقه یا دوایر متحدالمركزف دورههای تناوبی را تشكیل میدهند.
یكی از وجوه تمایز این دو طرح با دیگر طرحها و جدولها این است كه عناصر اكتینیدها و لانتانیدها به جای اینكه در خارج جدول قرار گیرند، در متن جدول و به دنبال عناصر اصلی دورههای تناوبی 6 و 7 قرار میگیرند.
منبع برخی مطالب: کتاب تاریخ مختصر
علم شیمی، مولفان: دکتر محمد رضا ملاردی و سید رضا آقاپور مقدم
باز نشر محتواها در فضای مجازی، ممنوع است.

باز نشر محتواها در فضای مجازی، ممنوع است.