اثر دما بر آنزیمها: چگونه فعالیت آنزیم با دما تغییر میکند؟
آنزیم چیست و چگونه کار میکند؟
برای درک اثر دما، ابتدا باید بدانیم آنزیم چیست. آنزیمها مولکولهای پروتئینی هستند که نقش کاتالیزور3 در بدن موجودات زنده را بازی میکنند. یعنی سرعت واکنشهای شیمیایی لازم برای زندگی را بدون آنکه خود مصرف شوند، افزایش میدهند. هر آنزیم شکل ویژهای دارد که فقط به مولکول خاصی، به نام سوبسترا4، میچسبد. به این محل اتصال، سایت فعال5 میگویند. مانند کلیدی که فقط قفل مخصوص به خود را باز میکند.
مثال ساده: آنزیم آمیلاز6 در بزاق دهان شما. وقتی نان (که حاوی نشاسته است) را میجوید، آمیلاز به مولکولهای نشاسته (سوبسترا) میچسبد و آنها را به قندهای کوچکتر تجزیه میکند. این فرآیند در دمای بدن (37°C) به بهترین شکل انجام میشود.
چرا دما برای فعالیت آنزیم مهم است؟
دما معیاری از انرژی گرمایی است. با افزایش دما، انرژی جنبشی مولکولها نیز افزایش مییابد. این مسئله دو اثر مهم بر آنزیم و سوبسترا دارد:
۱. افزایش برخوردها: مولکولهای سوبسترا و آنزیم با انرژی بیشتر و سریعتر حرکت میکنند، بنابراین احتمال برخورد موفق آنها در سایت فعال افزایش مییابد. در نتیجه، سرعت تشکیل محصول در یک محدودهٔ خاص، با افزایش دما بیشتر میشود.
۲. تغییر شکل آنزیم: آنزیم یک پروتئین است و شکل سهبعدی خاص خود را دارد. این شکل برای عملکرد صحیح حیاتی است. گرمای زیاد میتواند پیوندهای نگهدارندهٔ این ساختار را بشکند و باعث تغییر شکل (دناتوراسیون2) آنزیم شود. آنزیم دناتوره شده مانند کلیدی ذوب شده است که دیگر در قفل خود جا نمیرود و فعالیتش را از دست میدهد.
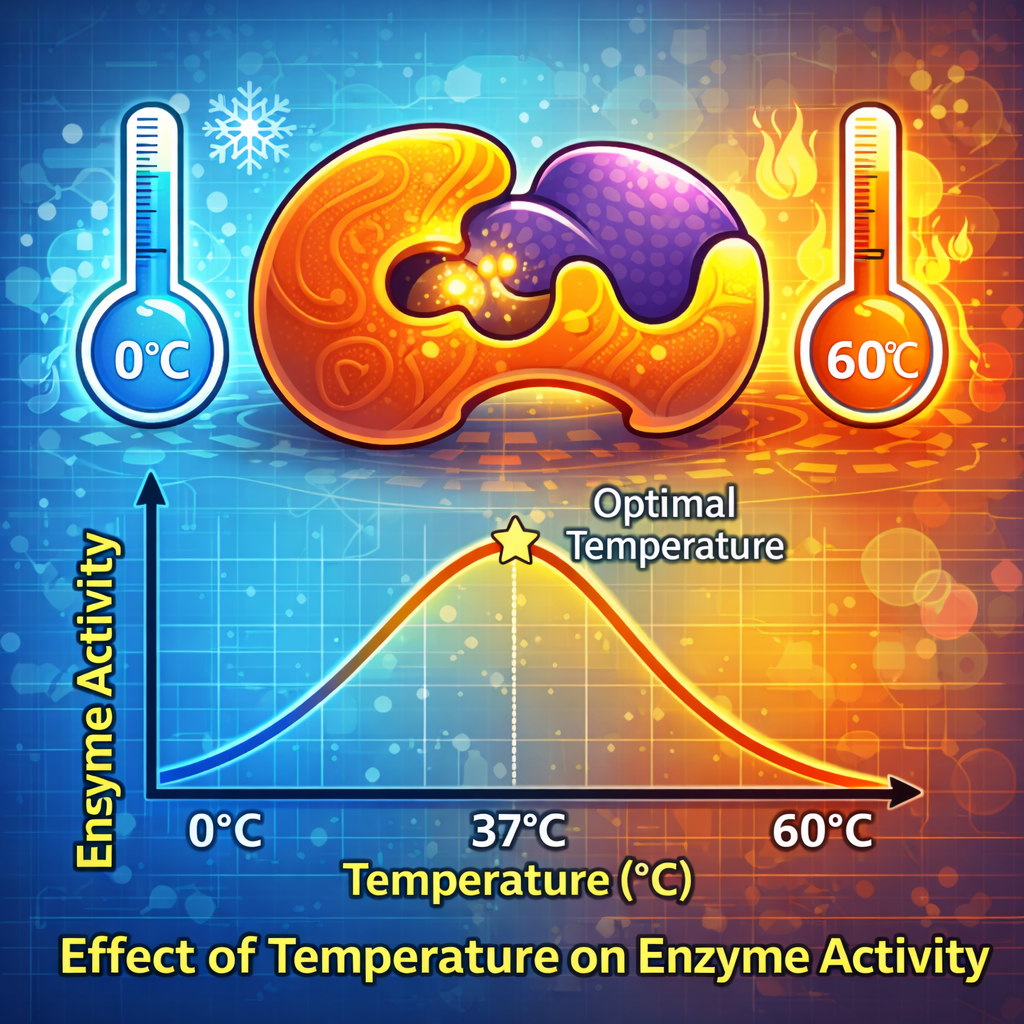
منحنی فعالیت آنزیم در برابر دما: یک رابطهٔ طلایی شکل
اگر فعالیت یک آنزیم (مثلاً سرعت تولید محصول) را در دماهای مختلف اندازهگیری و رسم کنیم، یک منحنی زنگولهای شکل به دست میآید. این منحنی سه ناحیهٔ اصلی دارد:
| محدودهٔ دمایی | تأثیر بر مولکولها | نتیجه بر فعالیت آنزیم | مثال |
|---|---|---|---|
| دمای پایین (مثلاً 0-20°C) | کاهش انرژی جنبشی و برخوردها | فعالیت بسیار کند. آنزیم معمولاً غیرفعال است ولی صدمه نمیبیند. | نگهداری مواد غذایی در یخچال برای کند کردن فساد آنزیمی |
| دمای بهینه7 (مثلاً 37-40°C برای آنزیمهای بدن انسان) | تعادل عالی بین برخوردهای پرانرژی و حفظ ساختار آنزیم | بیشترین فعالیت | هضم غذا در دمای طبیعی بدن |
| دمای بالاتر از بهینه | شروع شکستن پیوندها و تغییر شکل تدریجی آنزیم | کاهش سریع فعالیت | تب بالا که میتواند به سلولها آسیب بزند |
| دمای بسیار بالا (مثلاً بالای 60°C برای بسیاری از آنزیمها) | دناتوراسیون2 کامل (تغییر شکل برگشتناپذیر) | توقف کامل فعالیت | پختن تخممرغ (انعقاد پروتئینها) |
این منحنی را میتوان با یک رابطهٔ کیفی نشان داد: فعالیت ابتدا با دما افزایش مییابد، به اوج (بهینه) میرسد و سپس بهسرعت سقوط میکند. نقطهٔ اوج، همان دمای بهینه7 است.
از آزمایشگاه تا زندگی: مثالهای ملموس از اثر دما بر آنزیمها
این پدیده فقط در کتابهای درسی نیست، بلکه بخشی از زندگی روزمرهٔ ماست.
مثال ۱: پخت نان – خمیر نان حاوی مخمر است. مخمر یک موجود زندهٔ کوچک است که آنزیمهایی دارد تا شکر را به گاز دیاکسید کربن ($CO_2$) و الکل تبدیل کند. حبابهای $CO_2$ باعث پف کردن خمیر میشوند. اگر خمیر را در یخچال (دمای پایین) بگذاریم، فرآیند بسیار کند میشود. اگر در دمای اتاق (نزدیک بهینه) بگذاریم، با سرعت مناسبی پیش میرود. و اگر روی شوفاژ (دمای بالا) بگذاریم، مخمر و آنزیمهایش از بین میروند و خمیر هرگز پف نمیکند.
مثال ۲: دستگاه گوارش – آنزیمهای معده و رودهٔ ما برای کار در دمای 37°C بهینه شدهاند. هنگام تب شدید (40°C یا بیشتر)، ممکن است برخی از این آنزیمها شروع به دناتوره شدن کنند و در نتیجه هضم غذا دچار مشکل شود. به همین دلیل است که در زمان تب، اشتهای ما کم میشود.
مثال ۳: تولید ماست و پنیر – از آنزیم رنین8 (مایهٔ پنیر) برای دلمه بستن شیر استفاده میشود. این فرآیند در یک دمای خاص و کنترلشده (معمولاً حدود 30-40°C) انجام میشود تا آنزیم بهترین عملکرد خود را داشته باشد.
سازگاری شگفتانگیز: آنزیمهای موجودات در محیطهای افراطی
طبیعت همیشه راه حلی دارد! همهٔ آنزیمها دمای بهینهٔ 37°C ندارند. موجودات زنده در طول تکامل، آنزیمهایی با ساختار پروتئینی ویژهای تکوین دادهاند که با محیط زندگیشان سازگار است.
| نوع موجود زنده | محیط زندگی | دمای بهینهٔ نمونه آنزیمهای آن | توضیح |
|---|---|---|---|
| ماهی قطب شمال | آبهای یخزده | 0-10°C | آنزیمهای انعطافپذیرتری دارند که در دمای پایین هم میتوانند کار کنند. |
| انسان | خشکی معتدل | 37°C | دمای ثابت بدن. |
| باکتریهای گرمادوست | چشمههای آب گرم | 70-90°C یا بیشتر! | پیوندهای پروتئینی بسیار محکمتری دارند که در گرمای زیاد هم پایدار میماند. |
اشتباهات رایج و پرسشهای مهم
سوال: آیا سرمای زیاد (مثلاً فریزر) هم مانند گرمای زیاد، آنزیم را برای همیشه از بین میبرد؟
پاسخ: خیر. سرمای زیاد معمولاً باعث دناتوراسیون برگشتناپذیر نمیشود، بلکه فقط فعالیت آنزیم را متوقف میکند. مانند این است که آنزیم را به خواب زمستانی ببریم. وقتی دما به محدودهٔ طبیعی بازگردد، بسیاری از آنزیمها دوباره فعالیت خود را از سر میگیرند. به همین دلیل است که میتوان برخی آنزیمها را برای مدت طولانی در فریزر نگهداری کرد.
سوال: چرا تب بالا خطرناک است؟ آیا فقط به خاطر آسیب به آنزیمهاست؟
پاسخ: تب بالا (معمولاً بالای 40°C) چندین اثر مخرب دارد که یکی از مهمترین آنها دناتوراسیون آنزیمها و پروتئینهای حیاتی سلولهاست. وقتی آنزیمهای درگیر در تنفس سلولی، تولید انرژی یا همانندسازی9DNA از کار بیفتند، عملکرد سلول مختل شده و ممکن است منجر به مرگ سلولی یا آسیب به بافتها شود. البته تب بالا بر غشاهای سلولی و سایر مولکولها نیز تأثیر منفی میگذارد.
سوال: آیا میتوان دمای بهینهٔ یک آنزیم را تغییر داد؟
پاسخ: در شرایط طبیعی و در بدن موجودات، تغییر دمای بهینه کار سادهای نیست، زیرا به ساختار سهبعدی پیچیدهٔ پروتئین وابسته است. اما دانشمندان در آزمایشگاه از روشهایی مانند مهندسی پروتئین استفاده میکنند تا با تغییر اسیدهای آمینه10 سازندهٔ آنزیم، ساختار آن را اصلاح کنند و آنزیمهایی با ثبات دمایی بیشتر یا دمای بهینهٔ متفاوت بسازند. این آنزیمهای مهندسیشده در صنایع شیمیایی و داروسازی کاربردهای فراوانی دارند.
پاورقی
1 آنزیم (Enzyme): کاتالیزورهای زیستی با ماهیت پروتئینی که سرعت واکنشهای شیمیایی در سلول را افزایش میدهند.
2 دناتوراسیون (Denaturation): فرآیند تغییر شکل سهبعدی پروتئینها (از جمله آنزیم) در اثر عوامل مختلف مانند حرارت، که منجر به از دست دادن عملکرد طبیعی آنها میشود. این تغییر معمولاً برگشتناپذیر است.
3 کاتالیزور (Catalyst): مادهای که سرعت یک واکنش شیمیایی را افزایش میدهد، بدون آنکه خود در واکنش مصرف شود.
4 سوبسترا (Substrate): مولکول یا مولکولهایی که آنزیم بر روی آنها عمل میکند و آنها را به محصول تبدیل میکند.
5 سایت فعال (Active Site): ناحیهای خاص روی آنزیم که سوبسترا به آن متصل میشود و واکنش کاتالیزوری در آنجا رخ میدهد.
6 آمیلاز (Amylase): آنزیمی که نشاسته را به قندهای کوچکتر مانند مالتوز تجزیه میکند.
7 دمای بهینه (Optimum Temperature): دمایی که در آن یک آنزیم بیشترین سرعت فعالیت کاتالیزوری را نشان میدهد.
8 رنین (Rennin) یا کیموسین (Chymosin): آنزیمی که در معدهٔ نشخوارکنندگان جوان یافت میشود و پروتئین شیر (کازئین) را منعقد میکند. در صنعت پنیرسازی از آن استفاده میشود.
9 همانندسازی (Replication): فرآیند کپیبرداری از مولکول DNA.
10 اسیدهای آمینه (Amino Acids): واحدهای سازندهٔ مولکولهای پروتئین.