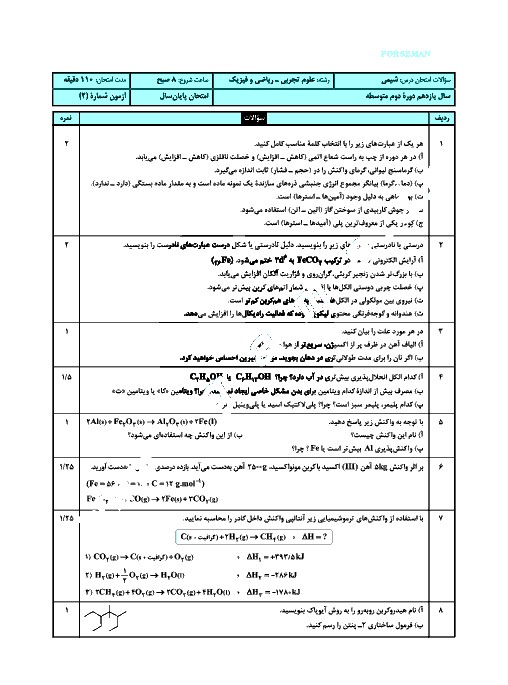
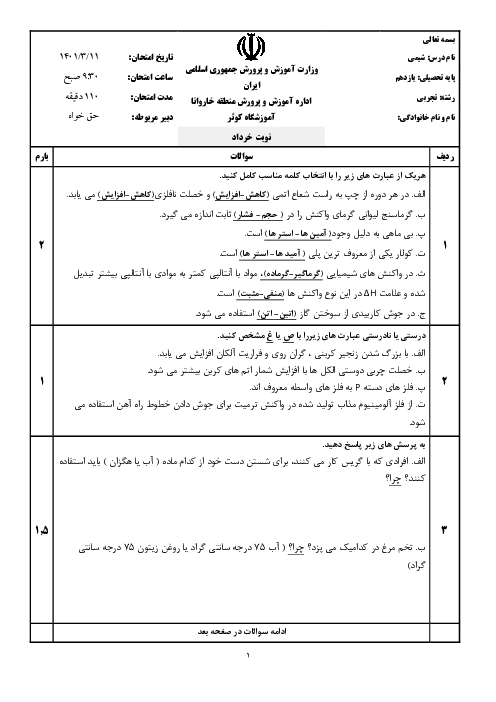
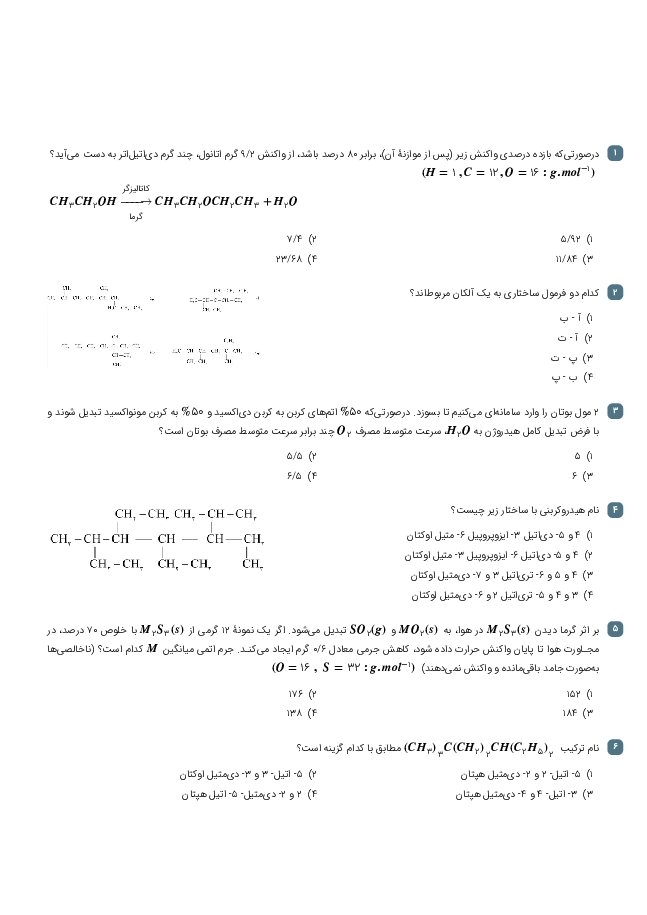
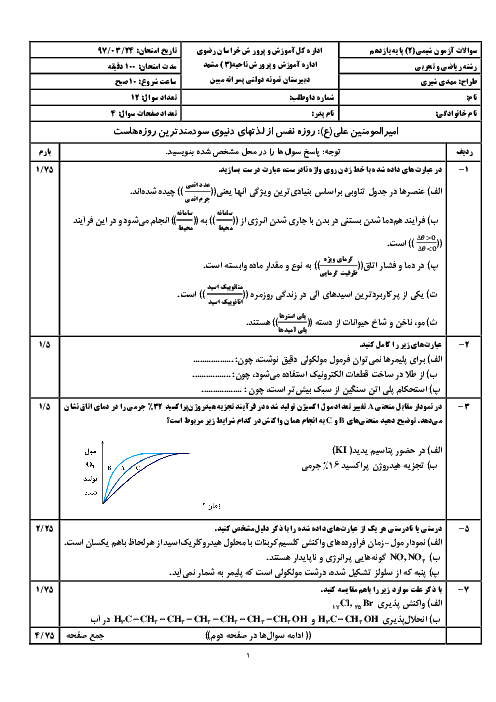
با توجه به واکنشهای ترموشیمیایی زیر در واکنش: $ClF(g)$ با $F_2(g)$ که منجر به تشکیل $ClF_3(l)$ میشود به ازای تولید 18/5 گرم محصول، چند kJ گرما مبادله میشود. $(F = 19,Cl = 35/5)$
${2ClF(g) + {O_2}(g) \to C{l_2}O(g) + O{F_2}(g)}\,\,\,\,\,\,\,\, {\Delta H = 167/5kJ} $
${2{F_2}(g) + {O_2}(g) \to 2O{F_2}(g)}\,\,\,\,\,\,\,\, {\Delta H = - 43/5kJ}$
${2Cl{F_3}(l) + 2{O_2}(g) \to C{l_2}O(g) + 3O{F_2}(g)}\,\,\,\,\,\,\,\, {\Delta H = 394/1kJ} $
پاسخ تشریحی :
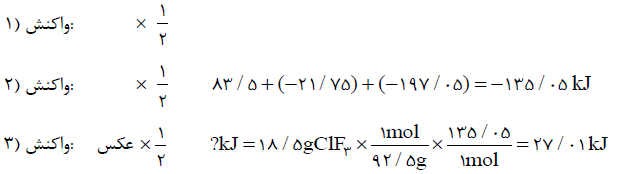
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!