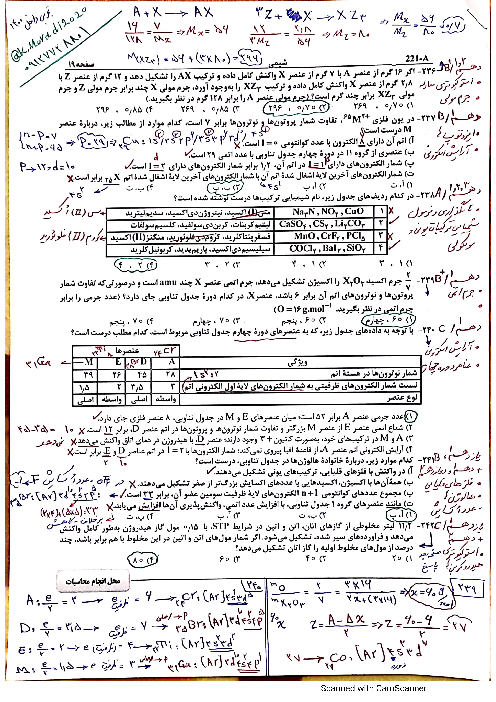
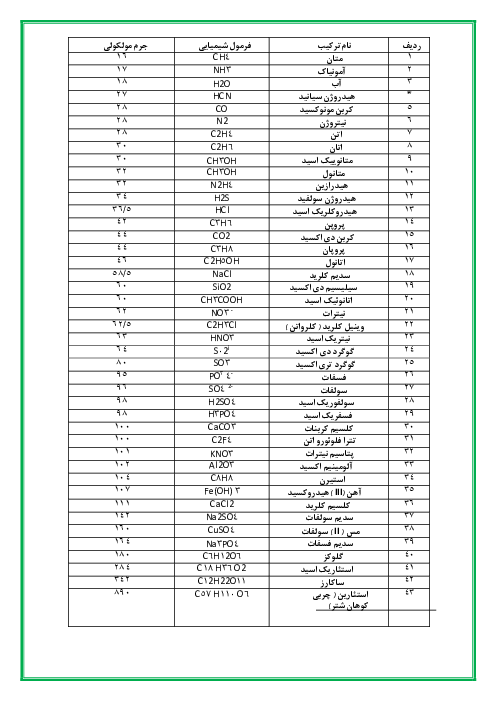
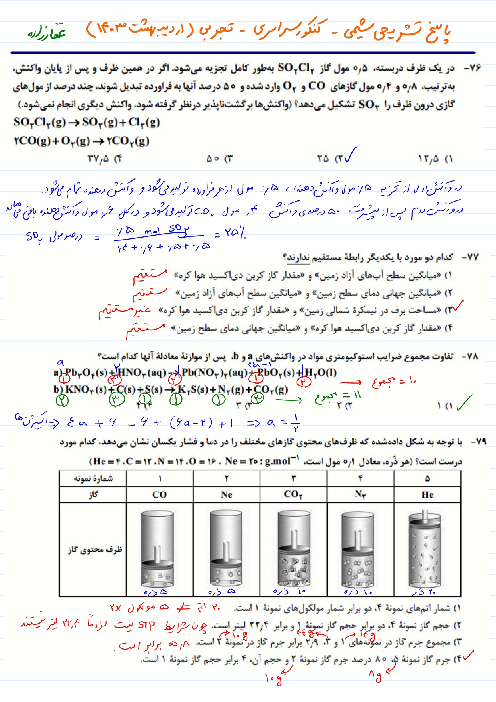
یک نیروگاه حرارتی در روز، 10 تن از یک نوع سوخت فسیلی را میسوزاند. اگر غلظت گوگرد در سوخت مصرفی برابر $6400ppm$ باشد، با فرض اینکه همهٔ گوگرد به طور کامل بسوزد، چند کیلوگرم آهک (کلسیم اکسید) برای جذب کامل گاز تولیدشده لازم است و آهک لازم در این فرایند را از تجزیهٔ گرمایی چند کیلوگرم کلسیم کربنات با خلوص 80 درصد میتوان تهیه کرد؟
$(Ca = 40,S = 32,O = 16,C = 12:g.mo{l^{ - 1}}$ گزینهها را از راست به چپ بخوانید)
$S{O_2}(g) + CaO(s) \to CaS{O_3}(s)$
$CaC{O_3}(s) \to C{O_2}(g) + CaO(s)$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!