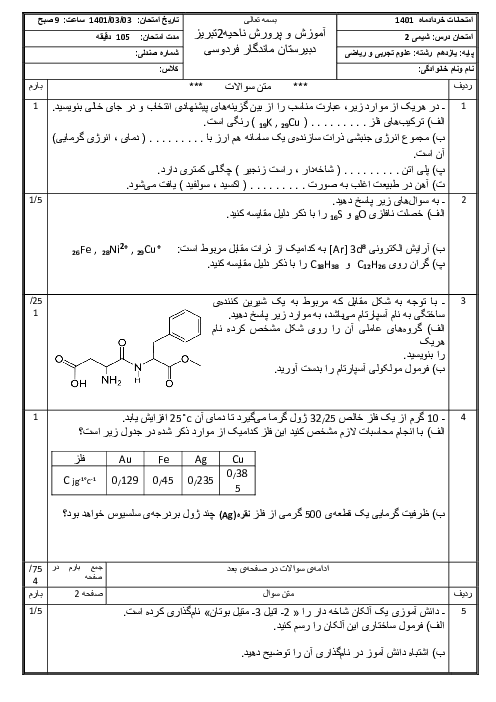
مقدار کافی محلول $A(aq)$ و $0/05$ مول محلول ${{X}_{2}}(aq)$، در دمای ${{25}^{{}^\circ }}C$ درون يک گرماسنج همدما مخلوط شدهاند. اگر دمای پايانی برابر ${{27}^{{}^\circ }}C$ و حجم نهایی محلول برابر $250$ میلیلیتر باشد، مقدار $\Delta H$ واکنش: $A(aq)+{{X}_{2}}(aq)\to Z(aq)$، چند $kJ$ است؟ (چگالی و ظرفيت گرمايی ويژهٔ همهٔ محلولها را مانند آب فرض كنيد. در اين فرايند، گرما تنها از واكنش شيميايی توليد میشود. از گرمای جذب شده به وسيله بدنهٔ گرماسنج صرفنظر شود.)
$(c$ آب $=4/2J.{{g}^{-1}}{{.}^{{}^\circ }}{{C}^{-1}},d$ محلول $\simeq 1g.m{{L}^{-1}})$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!