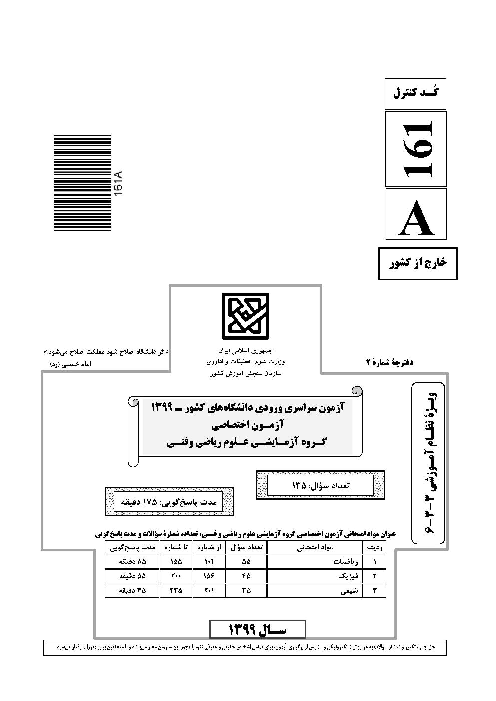
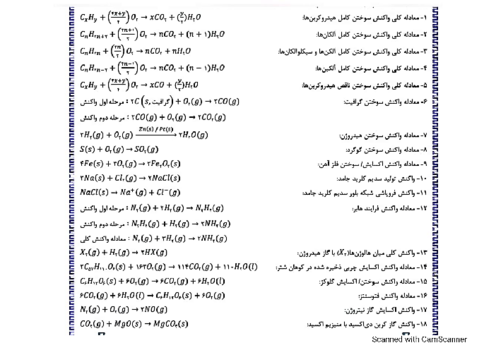
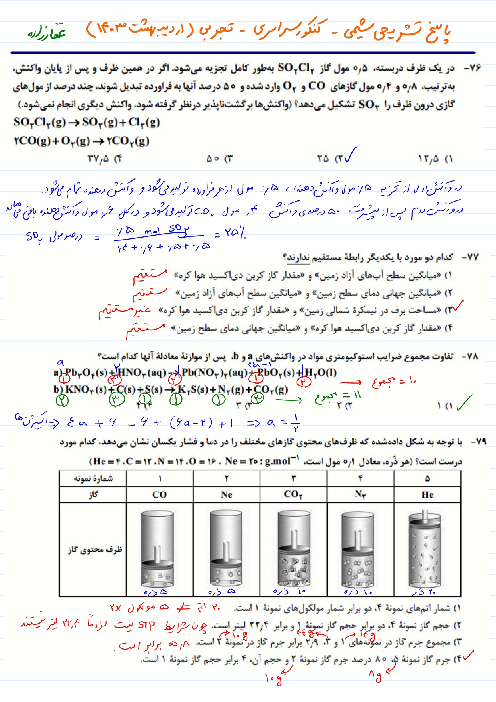
اگر قدرت اکسندگی چند یون به صورت ${{A}^{2+}}\gt {{B}^{2+}}\gt {{M}^{+}}\gt {{Y}^{2+}}$ و پتانسیل کاهشی استاندارد آنها بزرگتر از صفر باشد، چند مورد از مطالب زیر نادرست است؟
واکنش $B+YS{{O}_{4}}\to ...$ انجام پذیر است.
برای حفاظت از فلز آهن در برابر خوردگی، فلز $A$ مناسب تر از فلز $Y$ است.
emf سلول گالوانی «$Mg-A$» از emf سلول گالوانی «$Mg-B$» بیشتر خواهد بود.
اگر واکنش $M+XC{{l}_{2}}\to ...$ انجام پذیر باشد، واکنش $B+XC{{l}_{2}}\to ...$ نیز انجام پذیر است.
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!