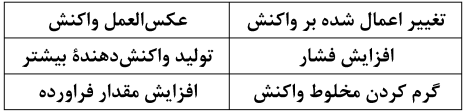
مطابق اصل لوشاتلیه، با افزایش فشار، واکنش در جهت تولید گاز کمتر پیش میرود تا به تعادل جدید برسد؛ با توجه به اینکه با افزایش فشار بر تعادل، واکنشدهندۀ بیشتری تولید شده است. میتوان دریافت که در معادلۀ واکنش موازنه شدۀ آن مجموع ضرایب استوکیومتری واکنشدهندههای گازی از فراوردههای گازی کمتر است.
همچنین مطابق اصل لوشاتلیه، با افزایش دما واکنش تعادلی در جهت مصرف گرما پیش میرود؛ با توجه به تولید بیشتر فراورده پس از گرم شدن مخلوط واکنش، میتوان دریافت که واکنش در جهت رفت گرماگیر بوده است.
بررسی سایر گزینهها:
گزینۀ «1» : در معادلۀ موازنه شدۀ واکنش، مجموع ضرایب استوکیومتری واکنشدهندههای گازی کمتر از مجموع ضرایب استوکیومتری فراوردههای گازی است.
گزینۀ «3» : با کاهش یا افزایش حجم ظرف در دمای ثابت، مقدار ثابت تعادل تغییری نمیکند.
گزینۀ «4» : در یک واکنش تعادلی، با خارج کردن مقداری فراوردۀ گازی، مواد واکنشدهنده مصرف شده و مقدار آنها کاهش مییابد. هرچند که در دمای ثابت، همواره مقدار K عددی ثابت است.