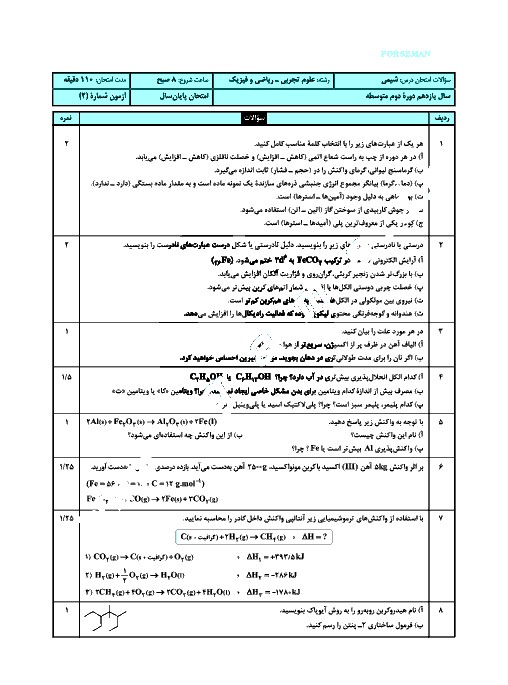
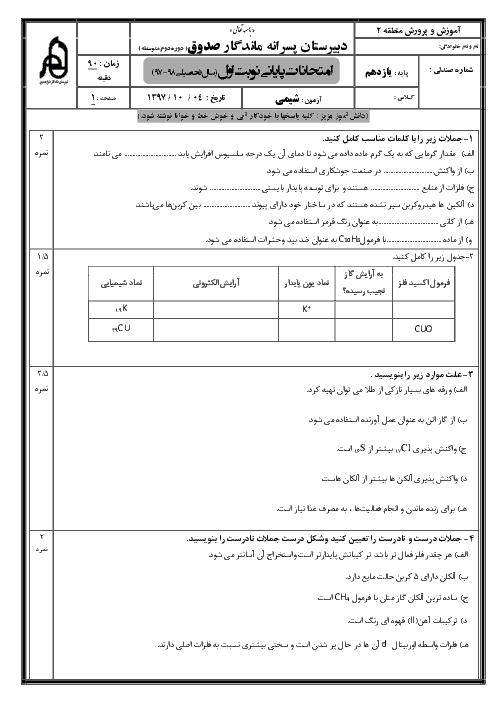
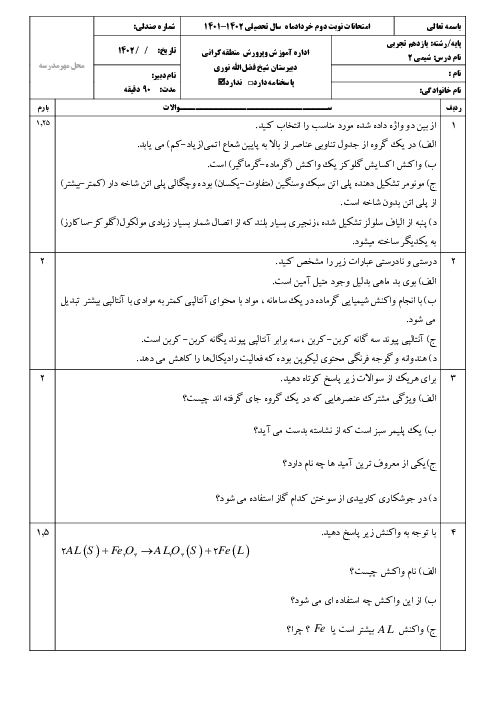
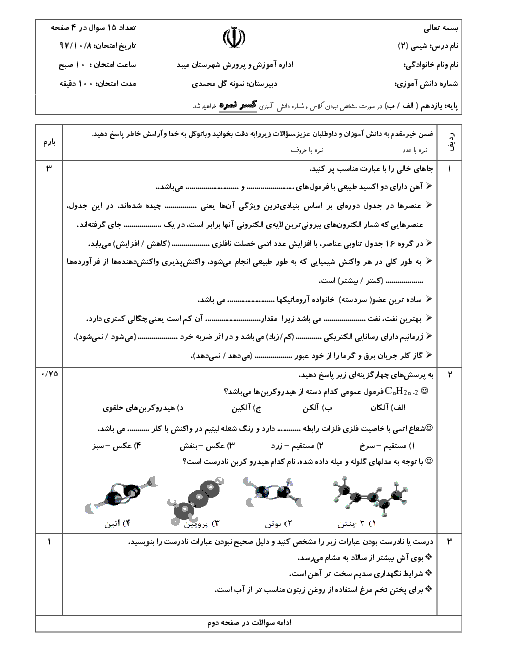
اگر در واکنش موازنه نشدۀ $F{{e}_{2}}{{O}_{3}}(s)+CO(g)\to Fe(s)+C{{O}_{2}}(g)$ ، حجم گاز تولیدی تا ثانیه دوم و چهارم به ترتیب برابر 1/25 و 7/5 لیتر باشد، در بازۀ زمانی 2 تا 4 ثانیه سرعت متوسط تولید گاز $C{{O}_{2}}$ چند گرم بر ثانیه و سرعت واکنش چند لیتر بر دقیقه است؟ (گزینهها را از راست به چپ بخوانیم.) ( حجم مولی گازها را 25 لیتر بر مول در نظر بگیرید.)
$(C=12,O=16:g.mo{{l}^{-1}})$
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!