ابتدا فرض میكنيم $x$ مول $NaBr$ و $y$ مول $NaI$ داريم. با توجه به واكنشهای انجام شده داريم:
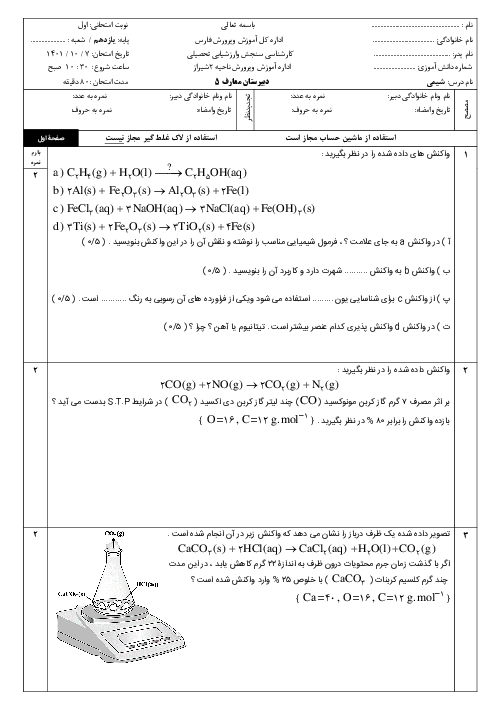
$AgN{{O}_{3}}(aq)+NaBr(aq)\to AgBr(s)+NaN{{O}_{3}}(aq)$
$AgN{{O}_{3}}(aq)+NaI(aq)\to AgI(s)+NaN{{O}_{3}}(aq)$
جرم نمونهٔ اولیه $:103x+150y=103/51g$
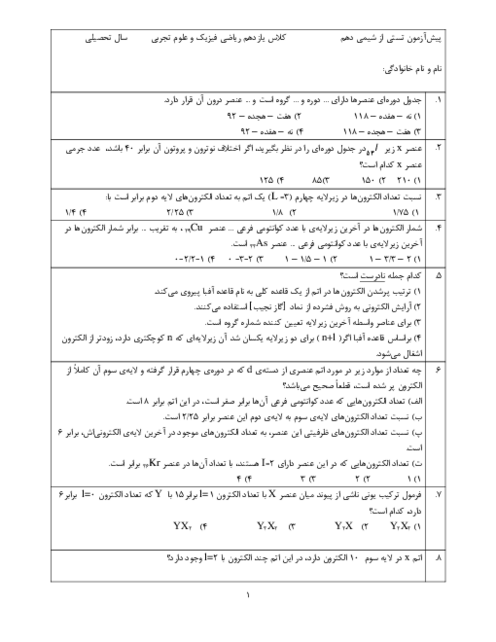
جرم رسوب $:188x+235y=180/01g$
$\Rightarrow \begin{matrix} x=0/67molNaBr \\ y=0/23molNaI \\ \end{matrix}$
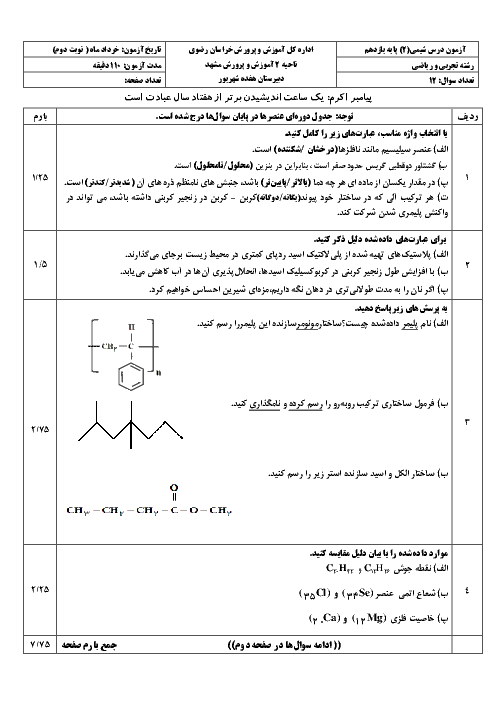
$\Rightarrow ?gNa=(0/67molNaBr\times \frac{1molNa}{1molNaBr}$
$+0/23molNaI\times \frac{1molNa}{1NaI})\times \frac{23gNa}{1molNa}=20/7gNa$
$Na%=\frac{20/7}{103/51}\times 100\simeq 20$ درصد