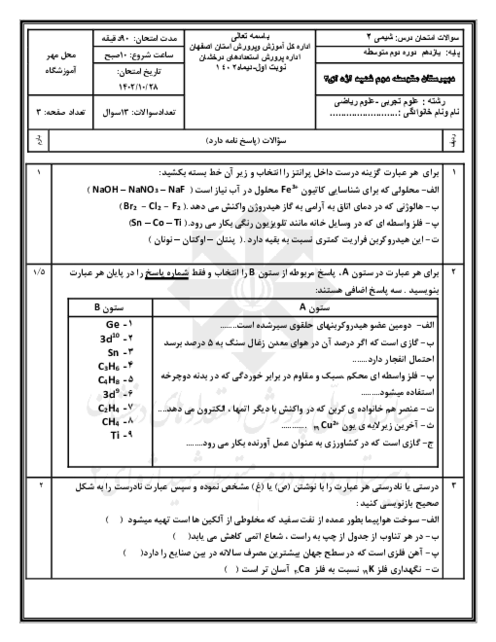
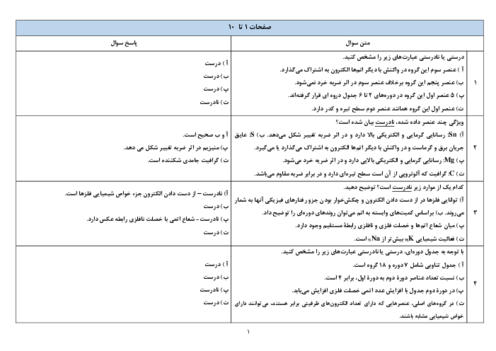
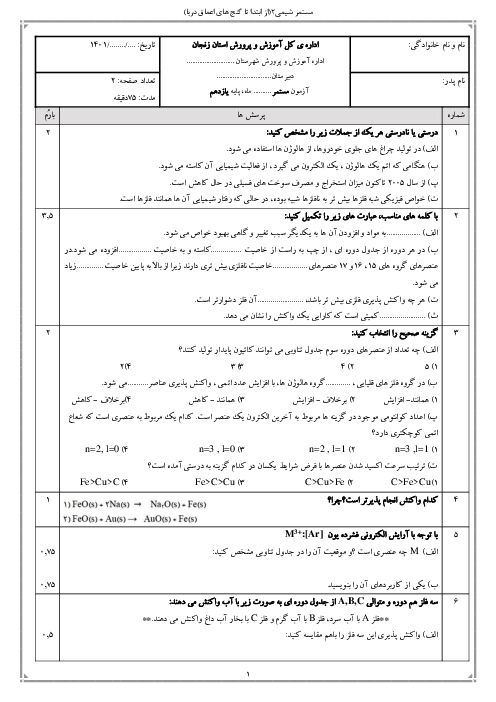
ШЁЩҮ Щ…ЩҶШёЩҲШұ ШӘЩҮЫҢЩҮЩ” 250 Щ…ЫҢЩ„ЫҢвҖҢЩ„ЫҢШӘШұ Щ…ШӯЩ„ЩҲЩ„ ШіШҜЫҢЩ… ЩҮЫҢШҜШұЩҲЪ©ШіЫҢШҜ ШЁШ§ ШәЩ„ШёШӘ 2 Щ…ЩҲЩ„Ш§ШұШҢ ЪҶЩҶШҜ ЪҜШұЩ… ШіШҜЫҢЩ… ЩҮЫҢШҜШұЩҲЪ©ШіЫҢШҜ ШЁШ§ Ш®Щ„ЩҲШөВ %80 Щ„Ш§ШІЩ… Ш§ШіШӘ ЩҲ Ш§ШІ ЩҲШ§Ъ©ЩҶШҙ 100 Щ…ЫҢЩ„ЫҢвҖҢЩ„ЫҢШӘШұ Ш§ШІ Ш§ЫҢЩҶ Щ…ШӯЩ„ЩҲЩ„ ШЁШ§ Щ…ЩӮШҜШ§Шұ Ъ©Ш§ЩҒЫҢ ШўЩҮЩҶ (III) Ъ©Щ„ШұЫҢШҜШҢ ШӘЩӮШұЫҢШЁШ§ЩӢ ЪҶЩҶШҜ ЪҜШұЩ… ШұШіЩҲШЁШҢ ШҜШұ ШөЩҲШұШӘЫҢ Ъ©ЩҮ ШЁШ§ШІШҜЩҮ ЩҲШ§Ъ©ЩҶШҙ %87 ШЁШ§ШҙШҜШҢ ШЁЩҮ ШҜШіШӘ Щ…ЫҢвҖҢШўЫҢШҜШҹ
($Na=23,\,O=16,\,H=1,\,Fe=56:g.mo{{l}^{-1}}$) (ЩҶШ§Ш®Ш§Щ„ШөЫҢвҖҢЩҮШ§ ШҜШұ ШўШЁ ШӯЩ„ Щ…ЫҢвҖҢШҙЩҲЩҶШҜ Ш§Щ…Ш§ ШҜШұ ЩҲШ§Ъ©ЩҶШҙ ШҙШұЪ©ШӘ ЩҶЩ…ЫҢвҖҢЪ©ЩҶЩҶШҜ.)
ШӘШӯЩ„ЫҢЩ„ ЩҲЫҢШҜШҰЩҲЫҢЫҢ ШӘШіШӘ
Щ…ЩҶШӘШёШұЫҢЩ… Ш§ЩҲЩ„ЫҢЩҶ ЩҶЩҒШұ ШӘШӯЩ„ЫҢЩ„Шҙ Ъ©ЩҶЩҮ!