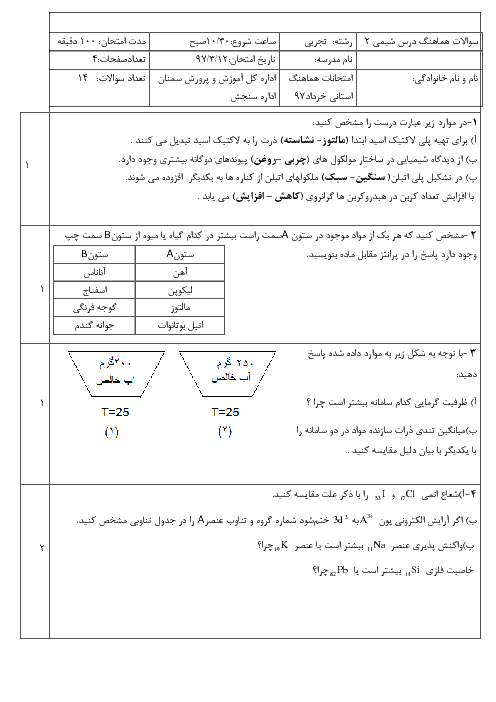
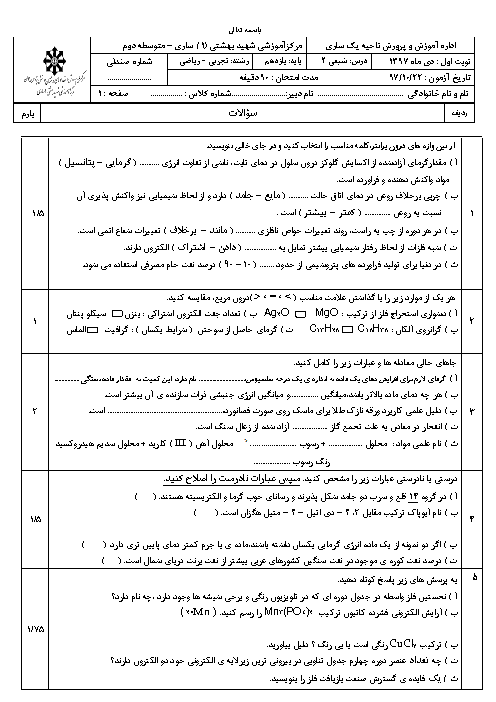
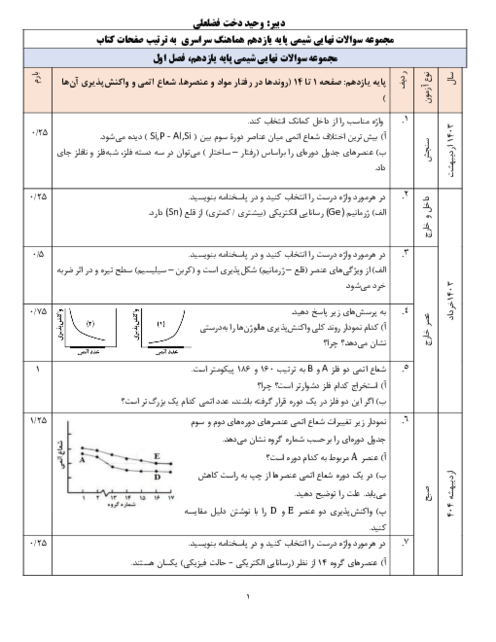
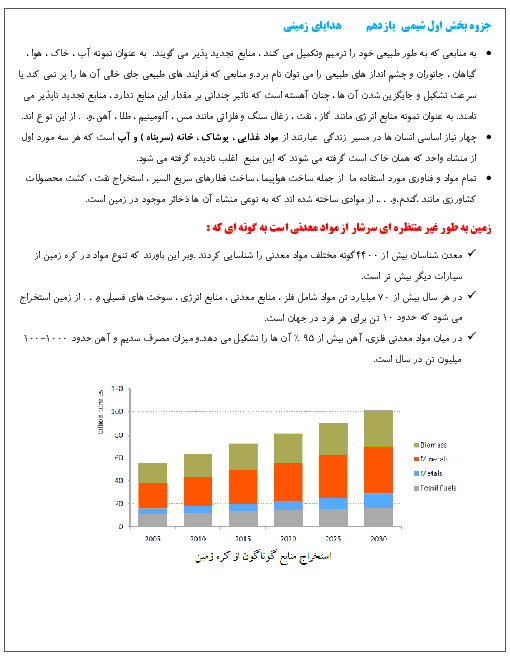
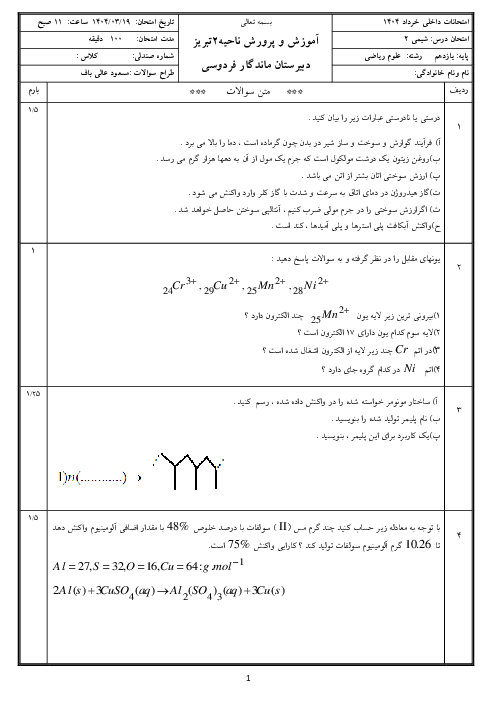
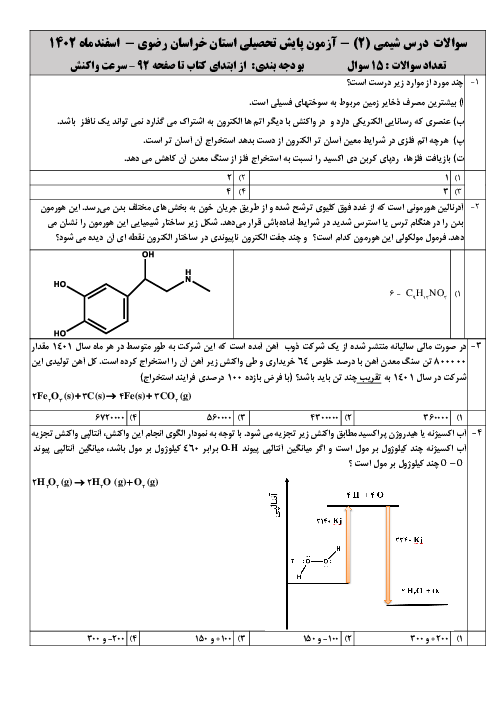
با توجه به دو واکنش زیر، کدام گزینه صحیح است؟
$\begin{align}
& I){{N}_{2}}(g)+3{{H}_{2}}(g)\xrightarrow{{{25}^{\circ }}c}2N{{H}_{3}}(g)+92kJ \\
& II){{N}_{2}}{{H}_{4}}(g)+{{H}_{2}}(g)\xrightarrow{{{25}^{\circ }}c}2N{{H}_{3}}(g)+183kJ \\
\end{align}$
1 )
چون در واکنش دوم گرمای بیشتری آزاد میشود، سطح انرژی فراوردهٔ واکنش دوم پایینتر از سطح انرژی فراوردهٔ واکنش اول است.
2 )
گاز ${{N}_{2}}$ ناپایدارتر از گاز ${{N}_{2}}{{H}_{4}}$ است و به همین دلیل سطح انرژی ${{N}_{2}}$ و ${{N}_{2}}{{H}_{4}}$ پایینتر است.
3 )
شمار مول گاز هیدروژن مصرفی در واکنش اول بیشتر است؛ پس سطح انرژی واکنشدهندهها در واکنش اول بالاتر است.
نمودار تغییرات انرژی برای هر دو واکنش نزولی است؛ زیرا در هر دو واکنش گرما آزاد میشود.
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!