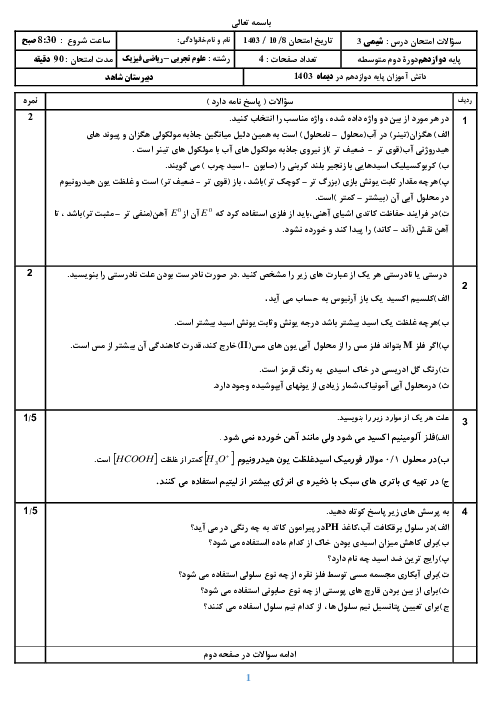
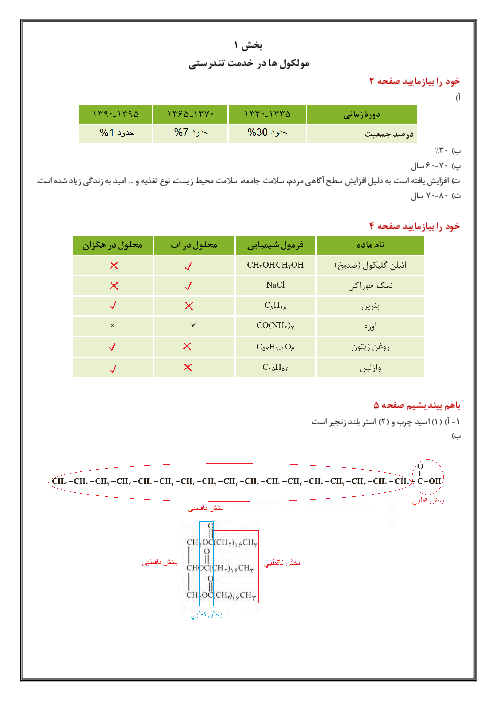
فرم معتبر نیست.
برای خنثی کردن دو لیتر اسید ضعیف HX با pH برابر 3/7، چند گرم NaOH مصرف میشود؟ درصد یونش اسید در محلول برابر 2/5 است. $(1molNaOH = 40g,\log 2 = 0/3)$
$HX(aq) + NaOH(aq) \to NaX(aq) + {H_2}O(l)$
پاسخ تشریحی :
نمایش پاسخ
$\eqalign{
& pH = 3/7 \to \left[ {{H^ + }} \right] = {10^{ - pH}} = {10^{ - 3/7}} = 2 \times {10^{ - 4}} \cr
& \alpha = \frac{{2/5}}{{100}} = \frac{{\left[ {{H^ + }} \right]}}{{\left[ {HX} \right]}} = \frac{{2 \times {{10}^{ - 4}}}}{{\left[ {HX} \right]}} \to \left[ {HX} \right] = 8 \times {10^{ - 3}} \cr
& 2LHX \times \frac{{8 \times {{10}^{ - 3}}molHX}}{{1LHX}} \times \frac{{1molNaOH}}{{1molHX}} \times \frac{{40gNaOH}}{{1molNaOH}} = 0/64NaOH \cr} $
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!
محتواهای آموزشی مشابه
فایل های پاورپوینت، ویدئو، صوتی، متنی و ...
پرسش و پاسخ های مشابه
سوال کنید یا به سوالات دیگران پاسخ دهید ...