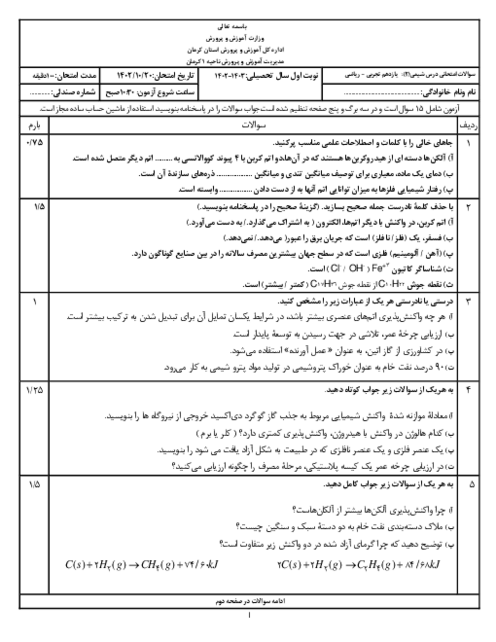
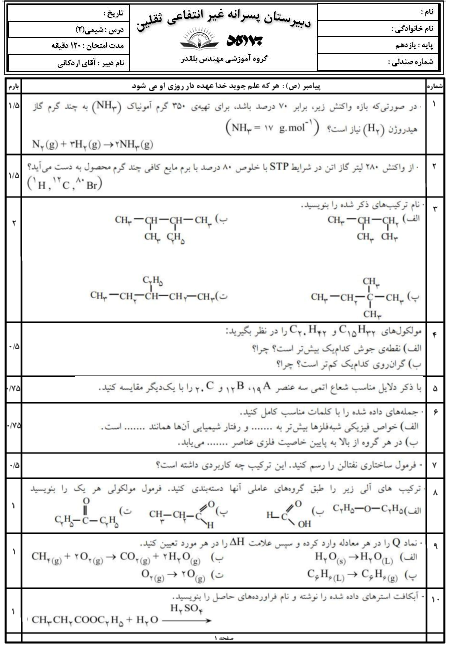
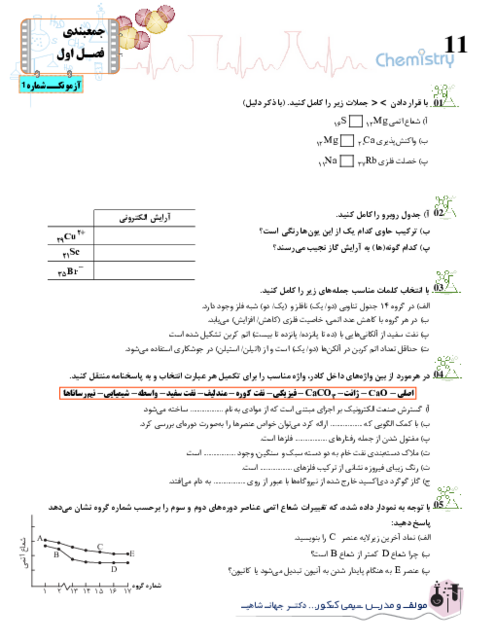
از واکنش 24,5 گرم آمونیوم نیترات $(N{H_4}N{O_3})$ با خلوص 70% مطابق واکنش زیر، 3,5 لیتر گاز ${N_2}O$ در شرایط STP تولید شده است. بازده درصدی واکنش را حساب کنید.
$\eqalign{
& (N{H_4}N{O_3} = 80\frac{g}{{mol}}) \cr
& N{H_4}N{O_3}(s) \to {N_2}O(g) + 2{H_2}O(g) \cr} $
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!