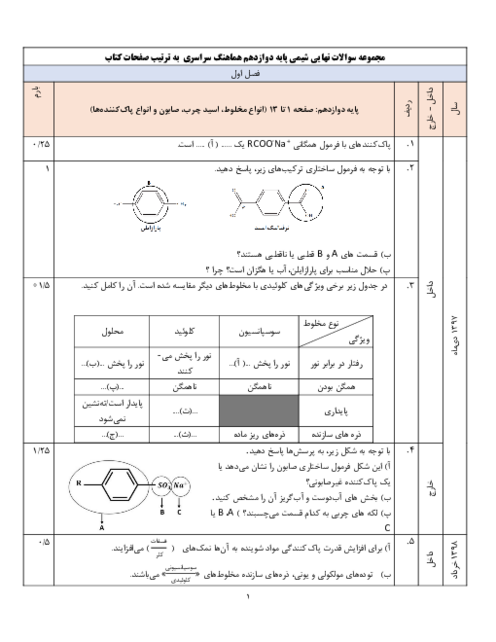
واکنش انجام شده، واکنشی گرماده است و با افزایش دما ثابت تعادل آن کاهش مییابد پس در دمای اتاق ثابت تعادل این واکنش برابر ${{K}_{3}}$ میباشد.
$2N{{O}_{2}}(g)\rightleftharpoons {{N}_{2}}{{O}_{4}}(g)+q$
مقدار اولیه $230g\times \frac{1mol}{46g}=5mol\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0$
تغییرات مول $-2x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,+x$
مقدار تعادلی $5-2x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x$
$K=4=\frac{\left[ {{N}_{2}}{{O}_{4}} \right]}{{{\left[ N{{O}_{2}} \right]}^{2}}}\Rightarrow 4=\frac{(\frac{x}{2})}{{{(\frac{5-2x}{2})}^{2}}}\Rightarrow x=\left\{ \begin{align} & 2 \\ & 3/125 \\ \end{align} \right.$
دقت کنید که مقدار عبارت $5-2x$ به ازای $x=3/125$ منفی میشود.
$?g{{N}_{2}}{{O}_{4}}=2mol{{N}_{2}}{{O}_{4}}\times \frac{92g{{N}_{2}}{{O}_{4}}}{1mol{{N}_{2}}{{O}_{4}}}=184g{{N}_{2}}{{O}_{4}}$