اگر در محلول 0/005 مولار استیک اسید $(C{H_3}COOH)$ غلظت یون هیدرونیوم برابر با $3 \times {10^{ - 4}}$ مول بر لیتر باشد.
الف) pH این محلول را محاسبه نمایید. $(\log 3 = 0/47)$
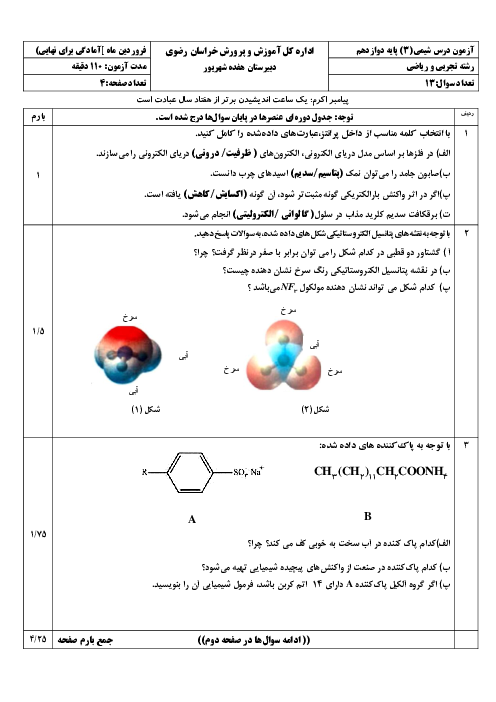
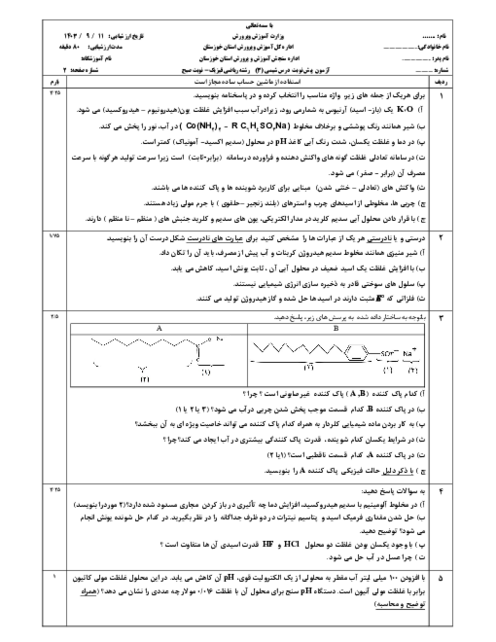
ب) معادلۀ یونش استیک اسید را بنویسید.
پ) درصد یونش را در این محلول بدست آورید.