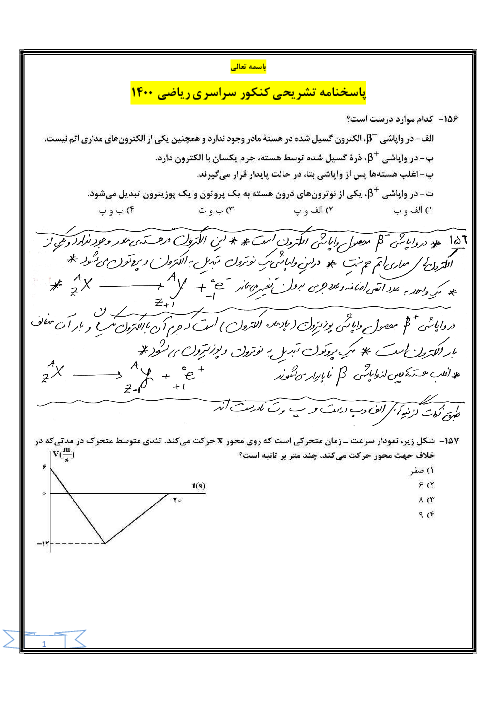
مقداری گاز آرمانی، طی یک فرایند بی دررو، از حالت $a$ به حالت $b$ میرود. کدام مورد درست است؟
1 )
${V_2} \gt \frac{1}{3}{V_1}$ و دمای گاز کاهش مییابد.
2 )
${V_2} \lt \frac{1}{3}{V_1}$ و دمای گاز کاهش مییابد.
${V_2} \gt \frac{1}{3}{V_1}$ و دمای گاز افزایش مییابد.
4 )
${V_2} \lt \frac{1}{3}{V_1}$ و دمای گاز افزایش مییابد.