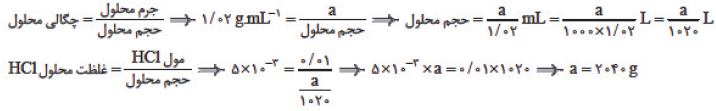در 5 تن از این پساب، $5\times 0/08=0/4$ گرم $NaOH$ وجود دارد. تعداد مول $HCl$ برای خنثی کردن این مقدار سدیم هیدروکسی برابر است با:
\[_{0/4g\cancel{NaOH}\times \frac{1\cancel{molNaOH}}{40\cancel{gNaOH}}\times \frac{1molHCl}{1\cancel{molNaOH}}=0/01molHCl}^{HCl+NaOH\to NaCl+{{H}_{2}}O}\]
حالا ببینیم در چند گرم محلول $HCl$ با $PH=2/3$، $0/01$ مول $HCl$ وجود دارد:
$\left[ HCl \right]=\left[ {{H}^{+}} \right]={{10}^{-PH}}={{10}^{-2/3}}={{10}^{-3}}\times {{10}^{0/7}}\xrightarrow[{{10}^{0/7}}=5]{\log =0/7}\left[ HCl \right]=5\times {{10}^{-3}}mol{{L}^{-1}}$
اگر جرم محلول را برابر $a$ گرم در نظر بگیریم، خواهیم داشت: