واکنشهای زیر بهطور طبیعی انجام میشوند:
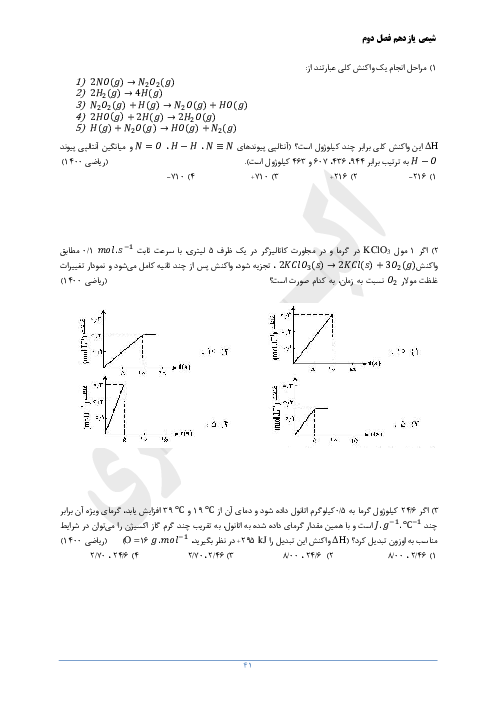
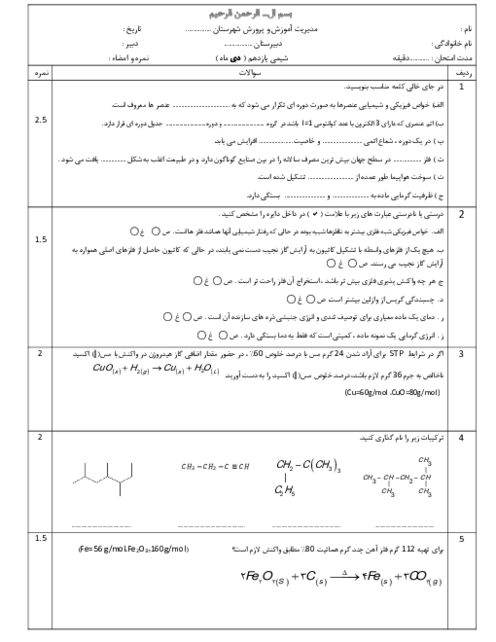
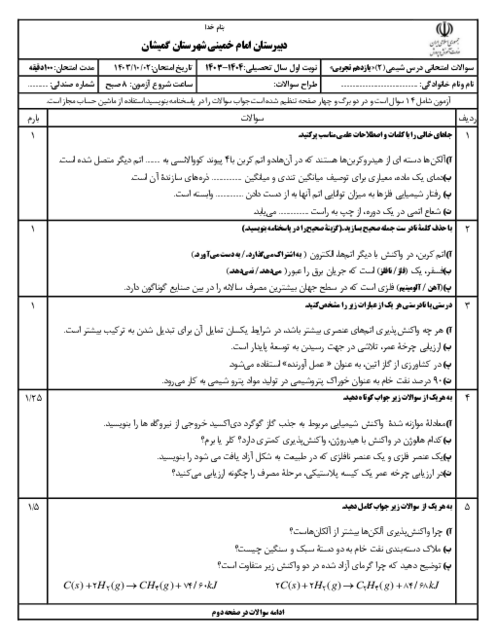
$1)2Al(s) + F{e_2}{O_3}(s) \to A{l_2}{O_3}(s) + 2Fe(l)$
$2)Fe(s) + CuO(s)\xrightarrow{\Delta }FeO(s) + Cu(s)$
الف) با توجه به واکنشپذیری دو فلز آلومینیوم و مس، آیا واکنش زیر بهطور طبیعی انجام میشود؟ توضیح دهید.
$3Cu(s) + 2Al{(N{O_3})_3}(aq) \to 3Cu{(N{O_3})_2}(aq) + 2Al(s)$
ب) در واکنش (2)، حساب کنید برای تولید 96 گرم فلز مس، به چند گرم فلز آهن با خلوص 80 درصد نیاز است؟
$(1molFe = 56g\,,\,1molCu = 64g)$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!