فصل 2: آسایش و رفاه در سایه شیمی
شیمی (3)
دوازدهم
متوسطه دوم نظری
علوم ریاضی
درسنامه آموزشی این مبحث
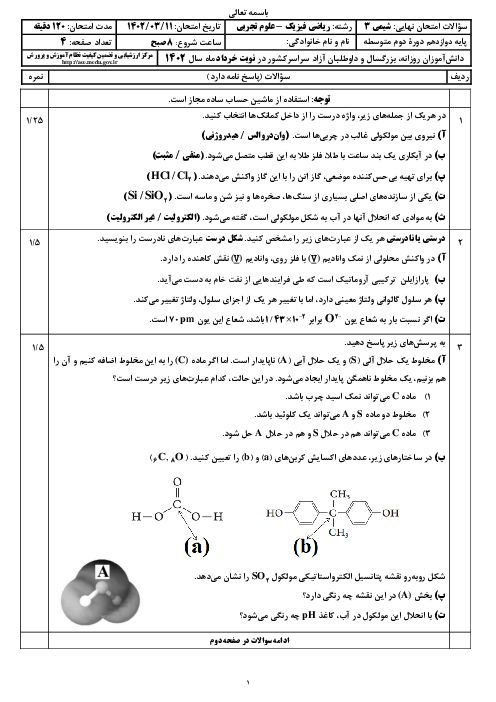
با تعداد الكترونهای مبادله شده برای توليد 40/5 گرم آلومينيم در فرايند هال، چند ميلیليتر آب را میتوان با استفاده از سلول سوختی بهدست آورد؟ $({{H}_{2}}O=18,Al=27:g.mo{{l}^{-1}}$ چگالی آب و $=1:g.m{{L}^{-1}})$