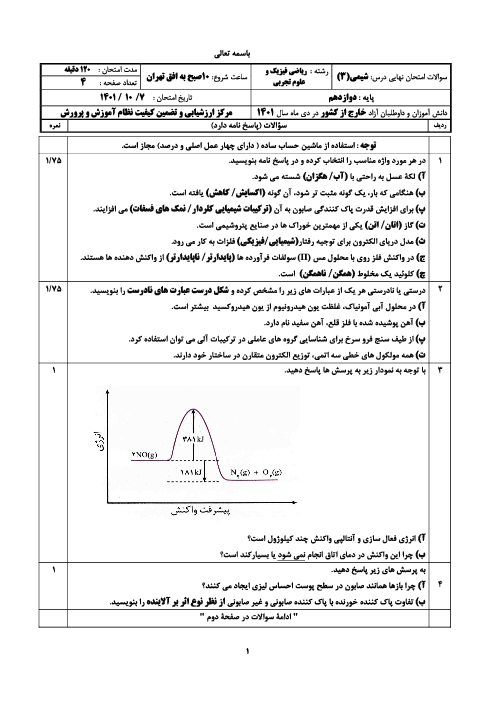
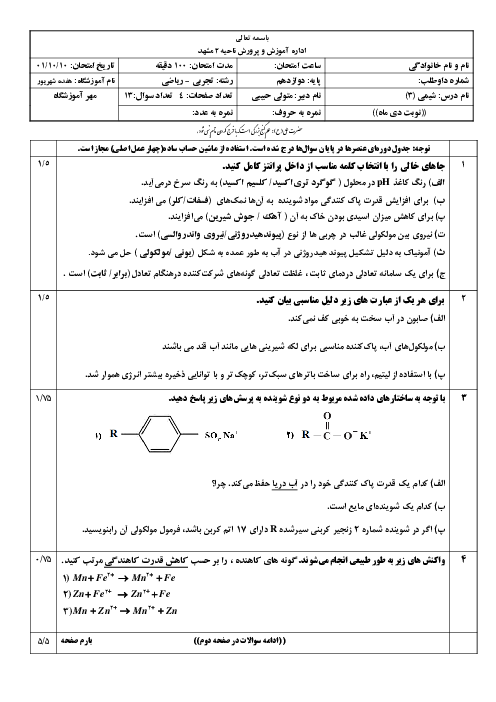
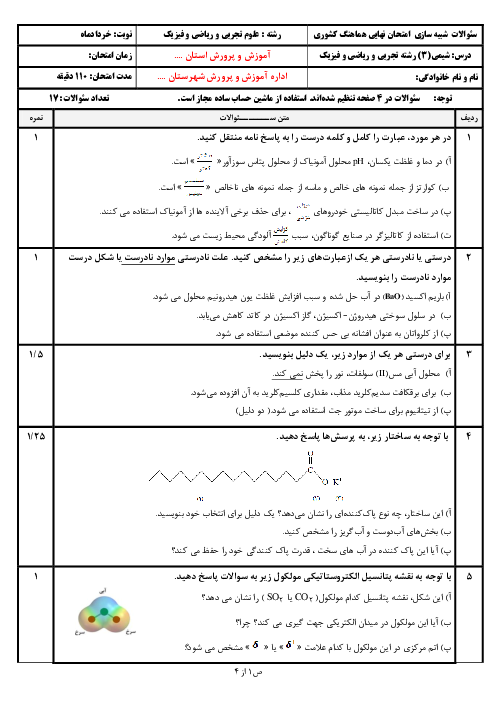
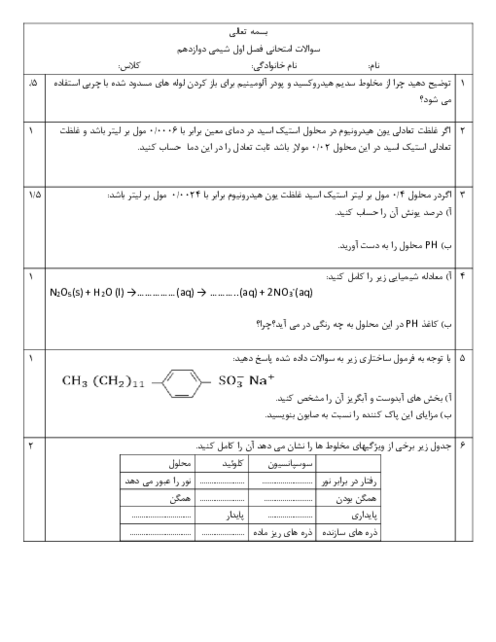
با توجه به مقدار تجزیه شده تا رسیدن به تعادل، خواهیم داشت:
$2/5mol{{N}_{2}}{{O}_{5}}\times \frac{20}{100}=0/5mol{{N}_{2}}{{O}_{5}}$
براساس ضرایب در واکنش موازنه شده، همراه با مصرف $0/5$ مول گاز پنتااکسیددینیتروژن، $1$ مول گاز نیتروژندیاکسید و $0/25$ مول گاز اکسیژن تولید میشود. البته در سامانهی تعادلی $2$ مول نیز گاز پنتااکسیددینیتروژن باقی مانده است. از سوی دیگر باید بدانید که غلظت مولی گازها از رابطهی روبهرو به دست میآید: شمار مول گازها ${}^{{}}/{}_{{}}$ حجم سامانه به لیتر
$K=\frac{{{\left[ \frac{1}{5} \right]}^{4}}.\left[ \frac{0/25}{5} \right]}{{{\left[ \frac{2}{5} \right]}^{2}}}=5\times {{10}^{-4}}$