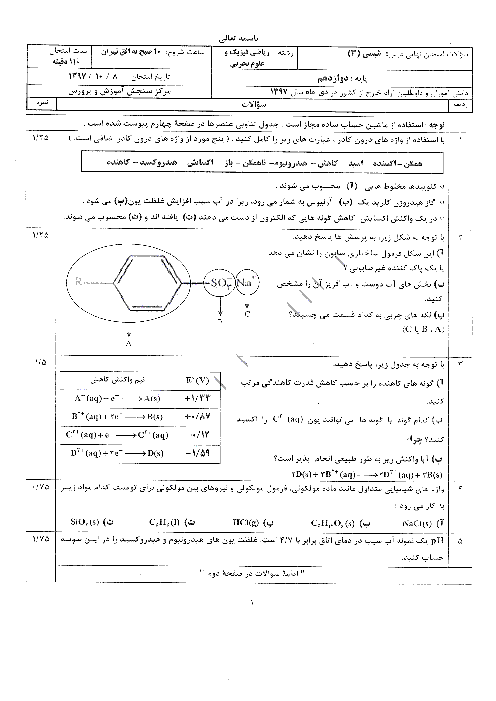
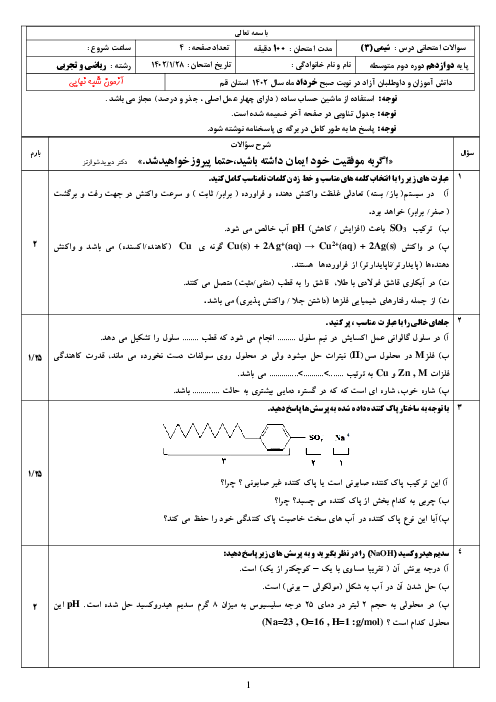
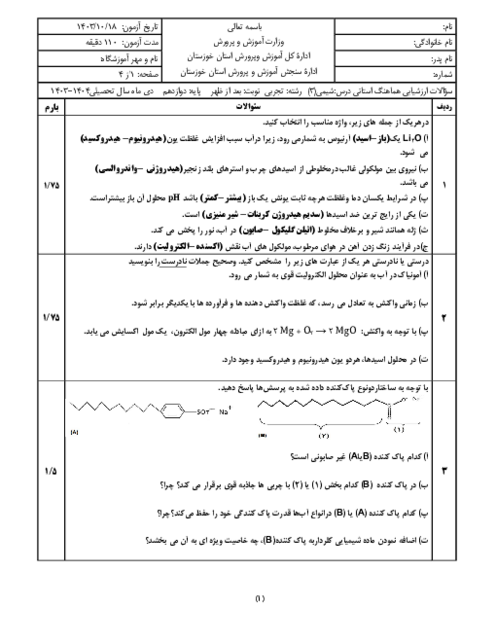
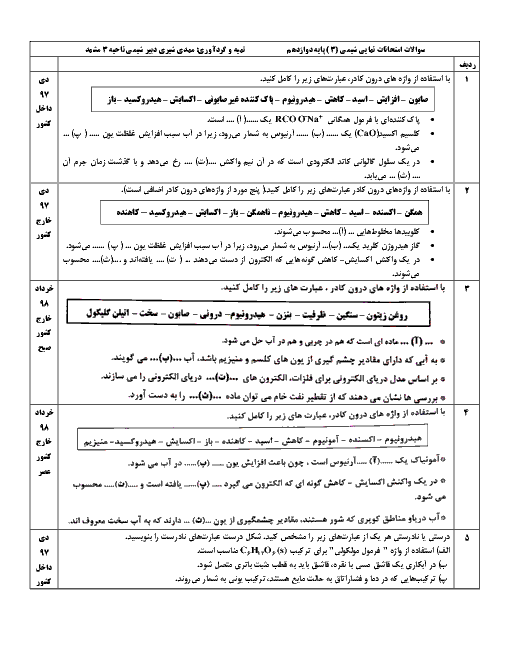
غلظت تعادلی یون هیدرونیوم در محلول هیدروفلوئوریک اسید در دمای معین برابر $0/005mol{L^{ - 1}}$ است، با توجه به معادله یونش این اسید در آب، به پرسشهای زیر پاسخ دهید.
$HF(aq) \rightleftharpoons {H^ + }(aq) + {F^ - }(aq)$
الف) غلظت تعادلی یون فلوئورید $\left[ {{F^ - }} \right]$ را با نوشتن دلیل تعیین کنید.
ب) اگر ثابت یونش $({K_a})$ اسید در این دما برابر $5/90 \times {10^{ - 4}}mol{L^{ - 1}}$ باشد، غلظت تعادلی $\left[ {HF} \right]$ را حساب کنید.