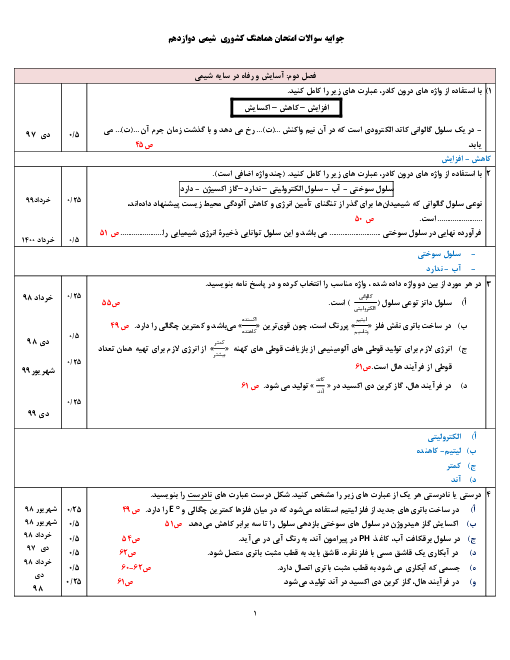
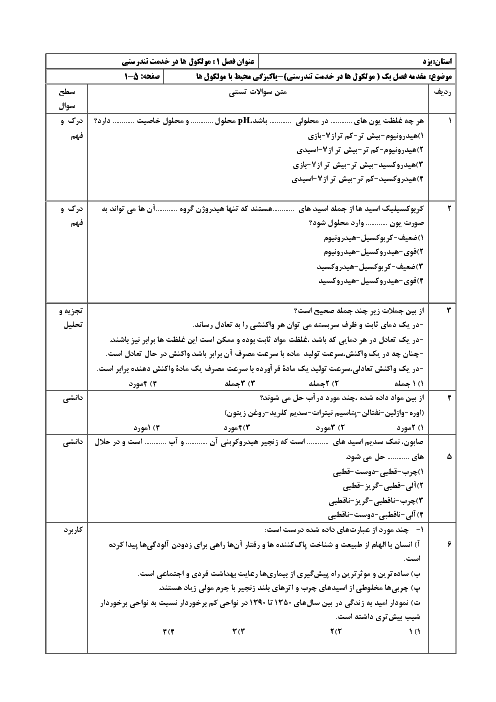
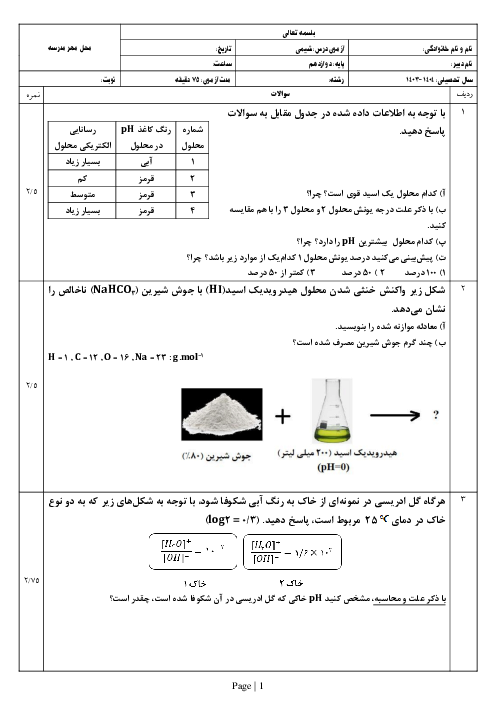
در دمای معین، pH محلولی به حجم 200mL از هیدروکلریکاسید با pH محلول 0/2 مولار استیکاسید که در این دما 15 درصد یونش مییابد، برابر است. مولاریته محلول هیدروکلریکاسید چند است و این مقدار اسید با چند گرم NaOH بهطور کامل خنثی میشود؟$\left(H=1, O=16, N a=23: g \cdot \mathrm{~mol}^{-1}\right)$
$\mathrm{HCl}(a q)+\mathrm{NaOH}(a q) \rightarrow \mathrm{NaCl}(a q)+\mathrm{H}_2 \mathrm{O}(l)$
1 )
$0 / 24 g \cdot 0 / 3 M$
2 )
$2 / 4 g \cdot 0 / 3 M$
$0 / 24 g ، 0 / 03 M$
4 )
$2 / 4 g .0 / 03 M$
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!