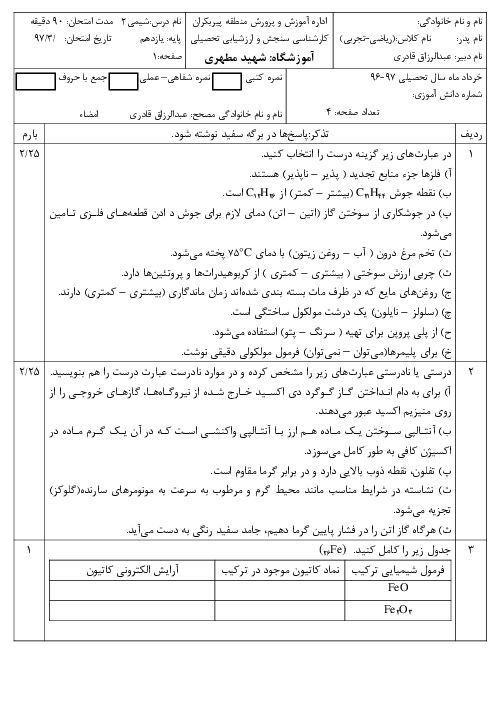
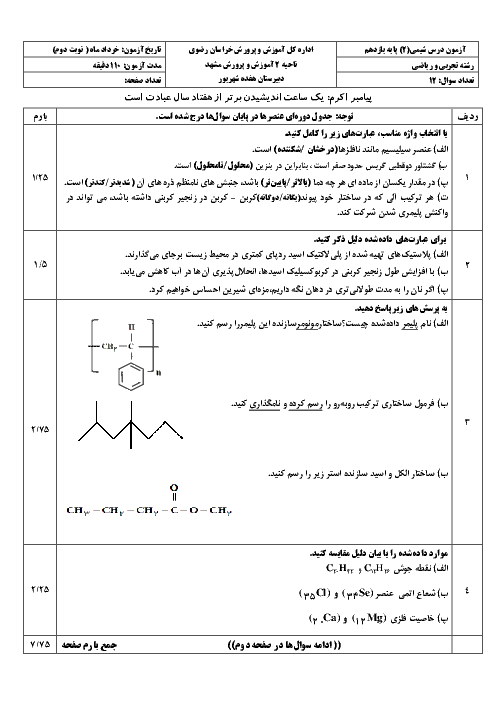
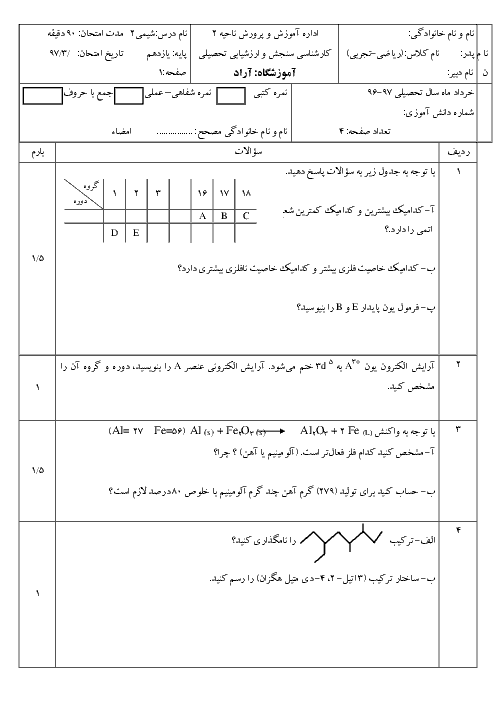
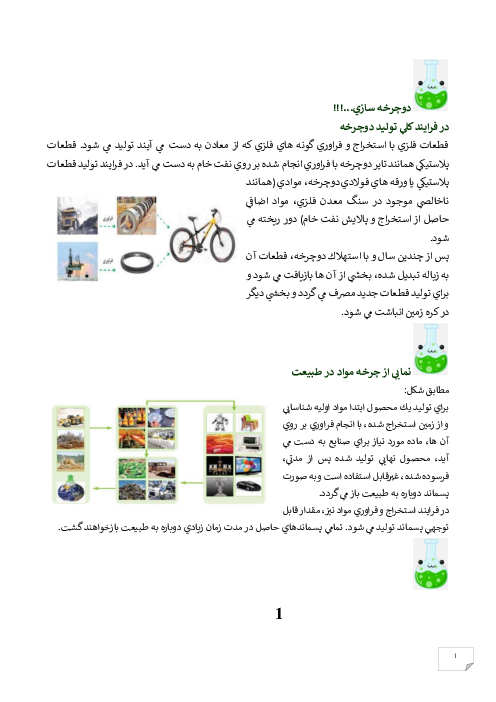
ابتدا مقدار اتانول تولید شده را محاسبه میکنیم:
بازده درصدی در واکنش تخمیر گلوکز را برابر x در نظر میگیریم:
$\begin{align} & {{C}_{6}}{{H}_{12}}{{O}_{6}}(aq)\to 2{{C}_{2}}{{H}_{5}}OH(aq)+2C{{O}_{2}}(g) \\ & ?mol{{C}_{2}}{{H}_{5}}OH=45g{{C}_{6}}{{H}_{12}}{{O}_{6}}\times \frac{60}{100}\times \frac{1mol{{C}_{6}}{{H}_{12}}{{O}_{6}}}{180g{{C}_{6}}{{H}_{12}}{{O}_{6}}} \\ & \times \frac{2mol{{C}_{2}}{{H}_{5}}OH}{1mol{{C}_{6}}{{H}_{12}}{{O}_{6}}}\times \frac{x}{100}=0/3\times {{10}^{-2}}xmol{{C}_{2}}{{H}_{5}}OH \\ \end{align}$
حال مقدار گاز $C{{O}_{2}}$ تولید شده از واکنش سوختن اتانول را تعیین میکنیم که با توجه به فرض سؤال را تعیین میکنیم که با توجه به فرض سؤال بازده درصدی آن برابر 2x است.
$\begin{align} & ?gC{{O}_{2}}=0/3\times {{10}^{-2}}xmol{{C}_{2}}{{H}_{5}}OH\times \frac{2molC{{O}_{2}}}{1mol{{C}_{2}}{{H}_{5}}OH} \\ & \times \frac{44gC{{O}_{2}}}{1molC{{O}_{2}}}\times \frac{2x}{100}=3/3gC{{O}_{2}} \\ & \Rightarrow 0/3\times {{10}^{-2}}x\times 2\times 2x\times 44=3/3\times 100\Rightarrow 528\times {{10}^{-3}}{{x}^{2}}=330 \\ & \Rightarrow {{x}^{2}}=625\Rightarrow x=25\% \\ \end{align}$