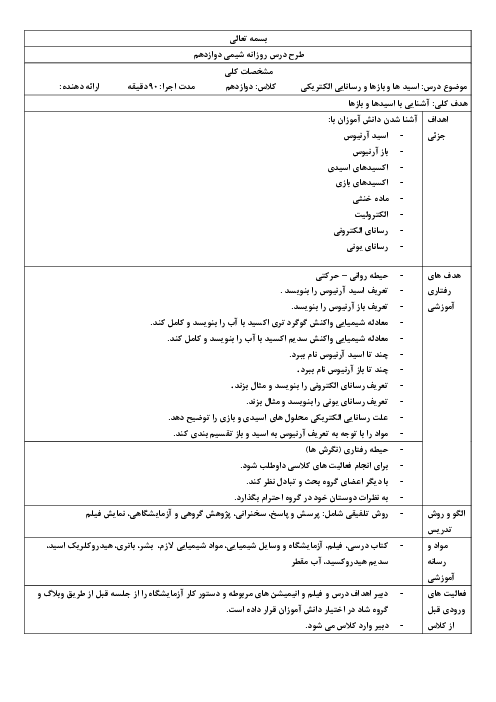
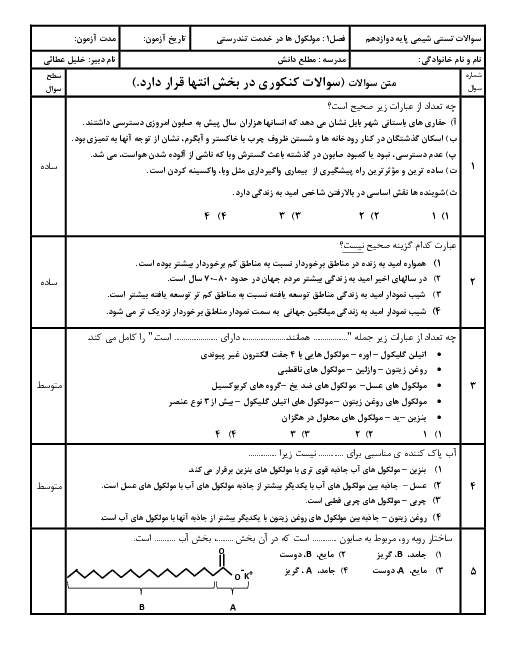
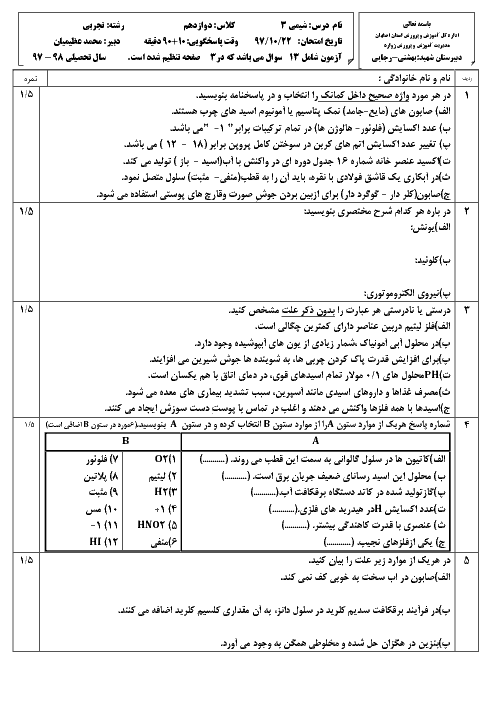
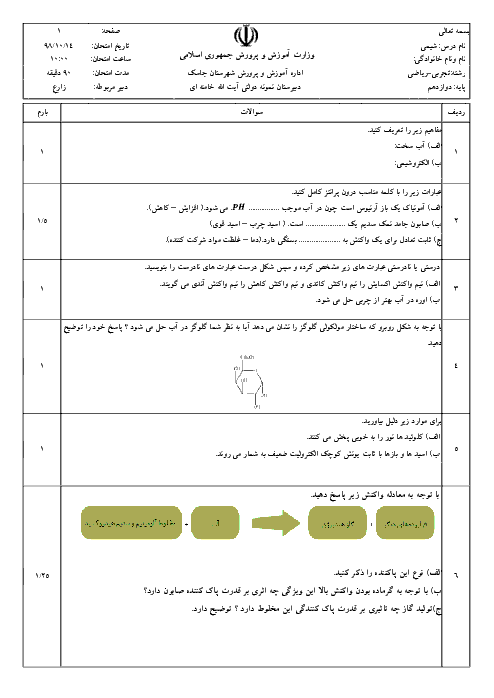
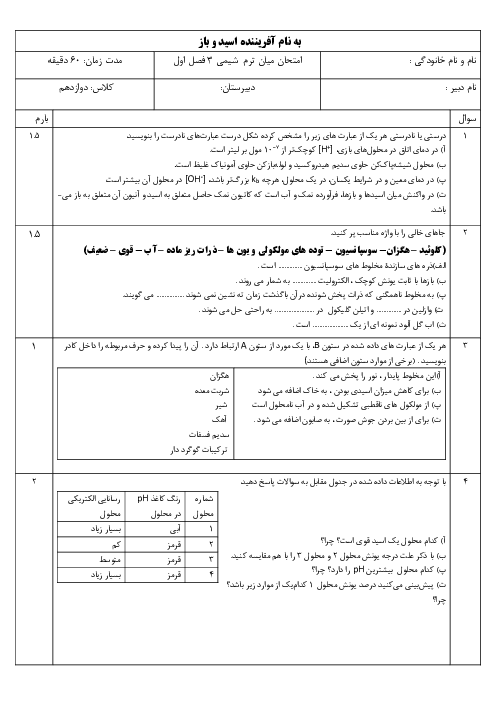
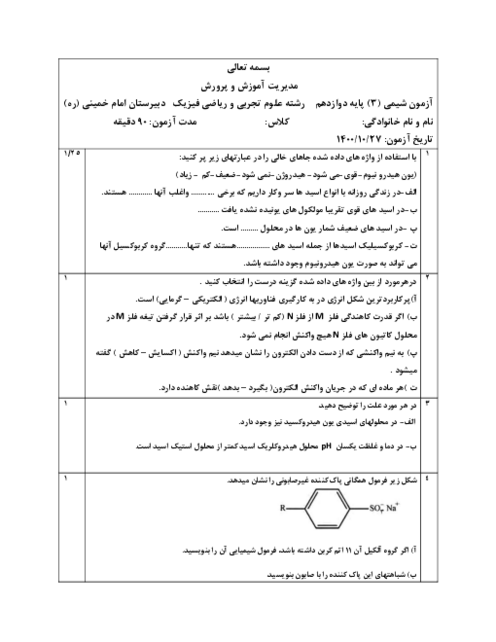
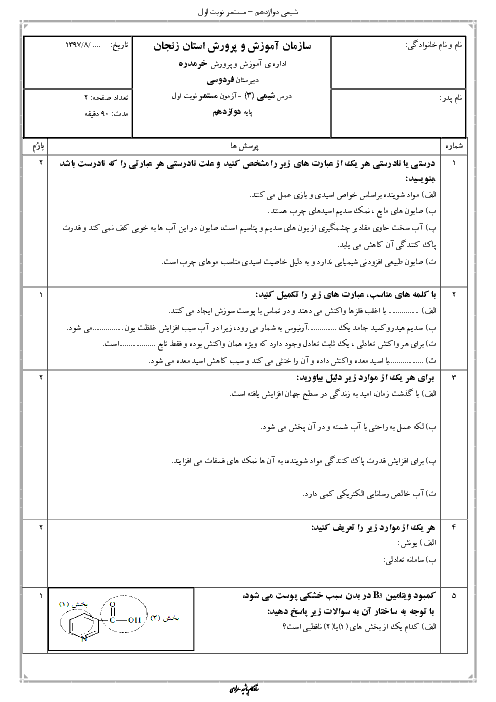
واکنش محلول نیتریک اسید با سدیم هیدروکسید اینطوراست:
\[_{_{HN{{O}_{3}}=5\times {{10}^{-2}}mol{{L}^{-1}}^{{}}\times 5L=0/25mol}^{\left[ HN{{O}_{3}} \right]=\left[ {{H}^{+}} \right]={{10}^{-PH}}={{10}^{-1/3}}={{10}^{-2}}\times {{10}^{0/7}}\xrightarrow[{{10}^{0/7}}=5]{\log =0/7}\left[ HN{{O}_{3}} \right]=5\times {{10}^{-2}}mol{{L}^{-1}}^{{}}}}^{HN{{O}_{3}}+NaOH\to NaN{{O}_{3}}+{{H}_{2}}O}\]
با توجه به معدلهی واکنش بهازای مصرف $0/25$ مول نمک $(NaN{{O}_{3}})$ تولید میشود.حالا به سراغ معادلهی موازنه شدهی این نمک میرویم:
\[_{0/25\cancel{molNaN{{O}_{3}}}\times \frac{1\cancel{mol{{O}_{2}}}}{2\cancel{molNaN{{O}_{3}}}}\times \frac{22/4L{{O}_{2}}}{1\cancel{mol{{O}_{2}}}}=2/8L{{O}_{2}}}^{2NaN{{O}_{3}}\to 2NaN{{O}_{2}}+{{O}_{2}}}\]