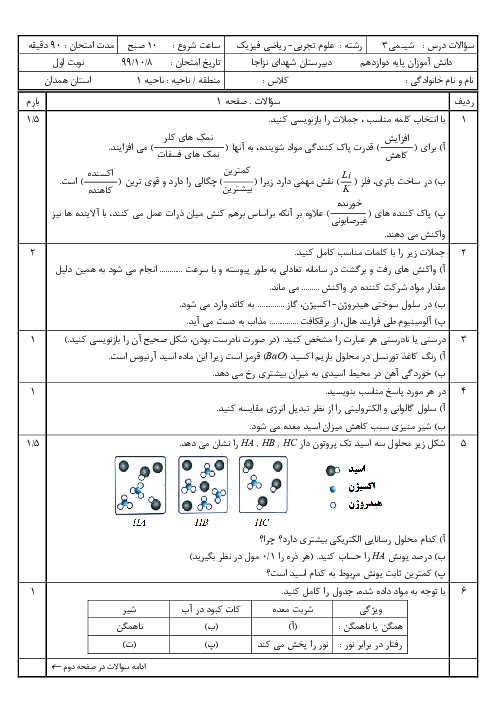
اگر غلظت تعادلی یون هیدرونیوم در محلول اسید HA در دمای معین برابر 0/001 مول بر لیتر و ثابت یونش این اسید برابر $1/8 \times {10^{ - 5}}$ باشد.
$HA(aq) \rightleftharpoons {H^ + }(aq) + {A^ - }(aq)$
الف) pH این محلول را بدست آورید.
ب) غلظت تعادلی اسید HA را در این دما محاسبه کنید.