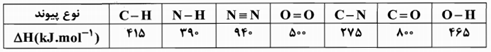
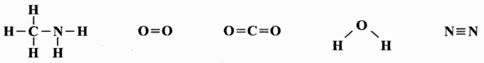قسمت 3: آنتالپی، آنتالپی پیوند، گروههای عاملی اکسیژندار و آنتالپی سوختن
شیمی (2)
یازدهم
متوسطه دوم نظری
علوم تجربی
درسنامه آموزشی این مبحث
آنتالپی سوختن متیل آمین گازی در دمای ${{25}^{{}^\circ }}C$ چند کیلوژول است؟ (اتم نیتروژن موجود در آمین بر اثر سوختن به گاز نیتروژن تبدیل میشود و آنتالپی تبخیر آب را $44kJ.mo{{l}^{-1}}$ در نظر بگیرید.)