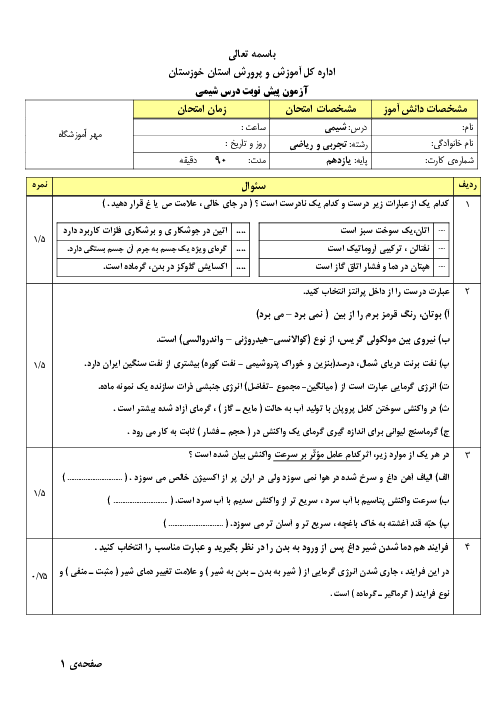
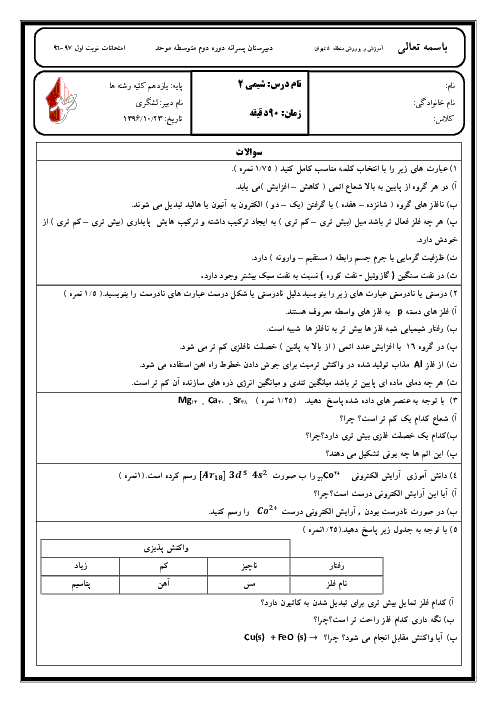
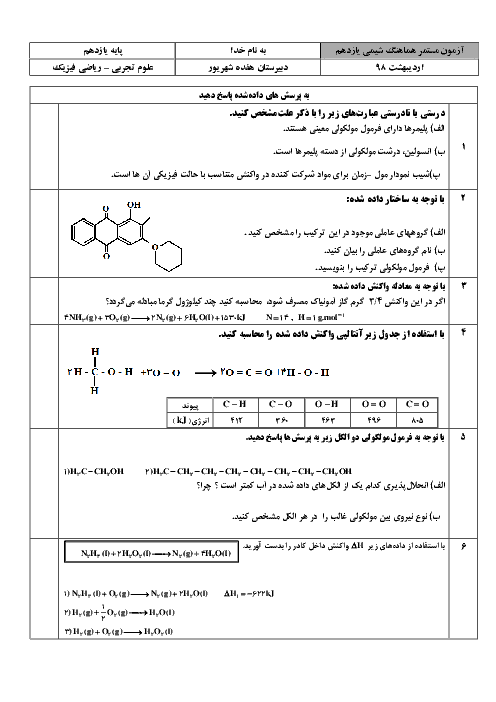
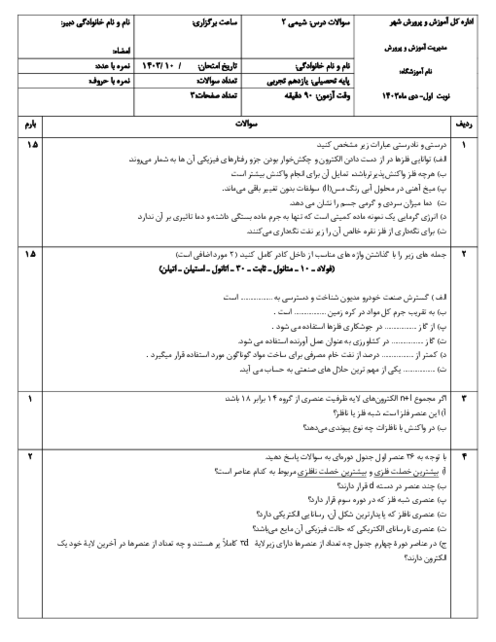
رابطه بین خاصیت فلزی و نافلزی و مقدار شعاع اتمی چیست؟ و با افزایش شعاع در فلزات و نافلزات چه تغییری در مقدار واکنش پذیری آنها به وجود میآید؟
رابطه بین خاصیت نافلزی و فلزی و شعاع اتمی چیست؟
پاسخ ها: {{ repliesNum }}
پاسخ انتخاب شده
در پاسخ به: {{ reply.reply_to.name }}
در پاسخ به
این پیام حذف شده است.