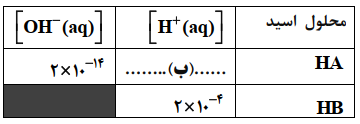
جدول زیر محلول اسید (HA) و (HB) را با غلظت مولی برابر در دمای ${25^ \circ }C$ نشان میدهد.
الف) pH محلول (HB) را حساب کنید.
ب) غلظت یون هیدرونیوم در محلول (HA) را حساب کنید.
ج) کدام محلول (HA) یا (HB) رسانایی الکتریکی بیشتری دارد؟ دلیل بنویسید.

گاما رو نصب کن!
جستجو
پربازدیدها: #{{ tag.title }}
به پاس اعتمادی که به گاما داشتی، ما اشتراک ویژهای رو برات فعال کردیم تا بدون هیچ نگرانی از محدودیت زمانی، از سرویسهای ویژه گاما استفاده کنی.
اگه به اطلاعات بیشتری نیاز داری راهنمای تغییرات جدید رو ببین.
از همراهیت با گاما سپاسگزاریم.
با تقدیم احترام
با سپاس! گزارش شما ثبت شد.
جدول زیر محلول اسید (HA) و (HB) را با غلظت مولی برابر در دمای ${25^ \circ }C$ نشان میدهد.
الف) pH محلول (HB) را حساب کنید.
ب) غلظت یون هیدرونیوم در محلول (HA) را حساب کنید.
ج) کدام محلول (HA) یا (HB) رسانایی الکتریکی بیشتری دارد؟ دلیل بنویسید.
