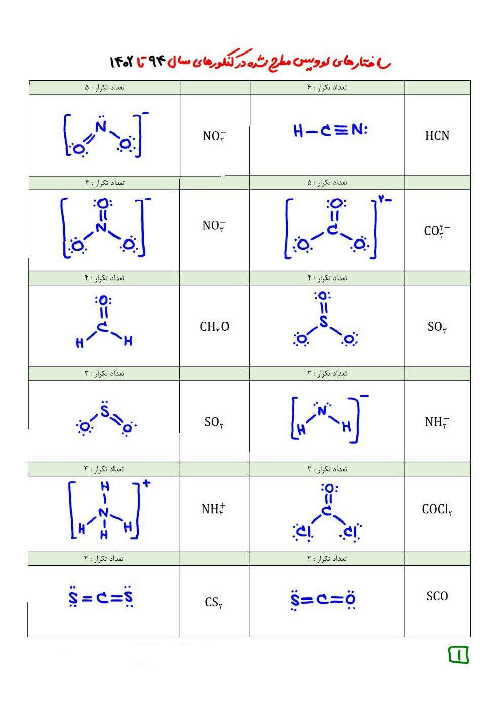
ثابت یونش اسید در دمای ${45^ \circ }C$ به ما داده شده ولی ما به ثابت یونش در دمای ${25^ \circ }C$ نیاز داریم. با توجه به اطلاعات دادهشده، ثابت یونش اسید در دمای ${45^ \circ }C$، به تقریب 25 درصد بیشتر از ثابت یونش آن در دمای ${25^ \circ }C$ است.
${K_a}({45^ \circ }C) = \underbrace {{K_a}({{25}^ \circ }C) + \frac{{12/5}}{{100}}{K_a}({{25}^ \circ }C)}_{1/125{K_a}({{25}^ \circ }C)}$
$ + \underbrace {\frac{{12/5}}{{100}}(1/125{K_a}({{25}^ \circ }C))}_{0/141{K_a}({{25}^ \circ }C)} \simeq 1/125{K_a}({25^ \circ }C)$
$ \Rightarrow {K_a}({25^ \circ }C) = \frac{{2 \times {{10}^{ - 4}}}}{{1/25}} = \frac{{2 \times {{10}^{ - 4}}}}{{\frac{5}{4}}} = 1/6 \times {10^{ - 4}}$
حالا معادلهٔ یونش را برای اسید در دمای ${25^ \circ }C$ مینویسیم:
$M - x = 6\,\,\,\,\begin{array}{*{20}{c}}
x&x
\end{array}$
${K_a} = \frac{{{x^2}}}{{M - x}} \Rightarrow 1/6 \times {10^{ - 4}} = \frac{{{x^2}}}{6}$
$ \Rightarrow {x^2} = 9/6 \times {10^{ - 4}}$
$ \Rightarrow x = \left[ {{H^ + }} \right] \simeq 3 \times {10^{ - 2}}mol.{L^{ - 1}}$
$\left[ {{H^ + }} \right]\left[ {O{H^ - }} \right] = {10^{ - 14}}$
$ \Rightarrow \left[ {O{H^ - }} \right] = \frac{{{{10}^{ - 14}}}}{{3 \times {{10}^{ - 2}}}} = \frac{1}{3} \times {10^{ - 12}}$
$\frac{{\left[ {O{H^ - }} \right]}}{{\left[ {{H^ + }} \right]}} = \frac{{\frac{1}{3} \times {{10}^{ - 12}}}}{{3 \times {{10}^{ - 2}}}} = \frac{1}{9} \times {10^{ - 10}} = 0/11 \times {10^{ - 10}}$
$ = 1/1 \times {10^{ - 11}}$
بریم سراغ قسمت دوم!
با افزایش دما، ثابت یونش اسید و در نتیجه غلظت یون هیدرونیوم افزایش مییابد. بنابراین با افزایش دما نسبت غلظت یون هیدرونیوم به هیدروکسید زیاد میشود، یعنی نسبت غلظت یون هیدروکسید به هیدرونیوم کمتر میشود؛ یعنی همونی که سؤال میخواد!