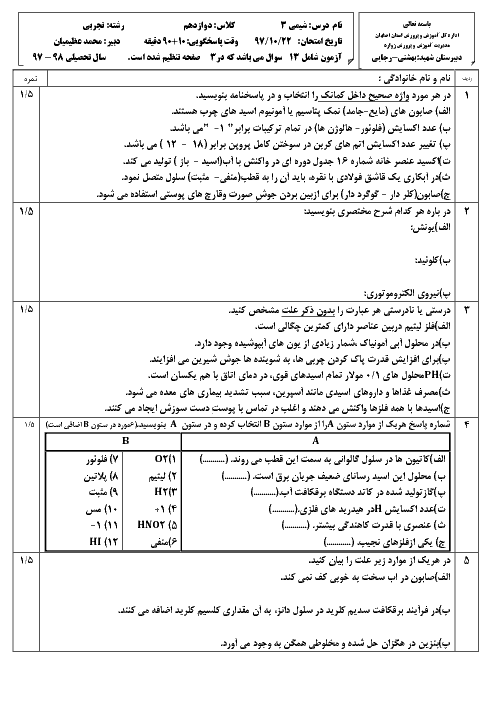
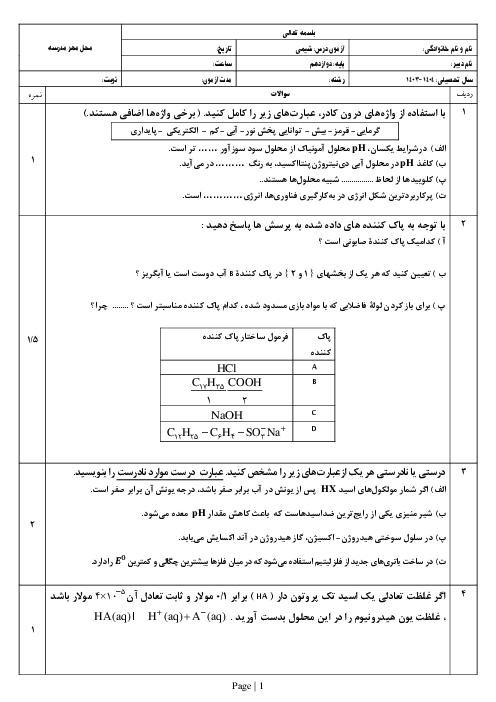
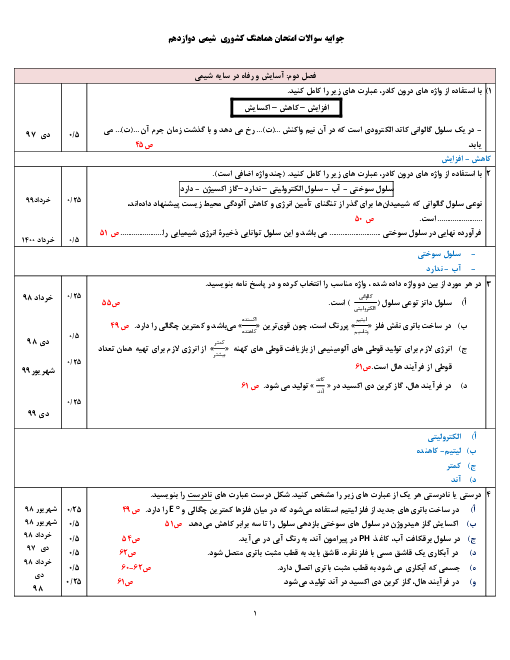
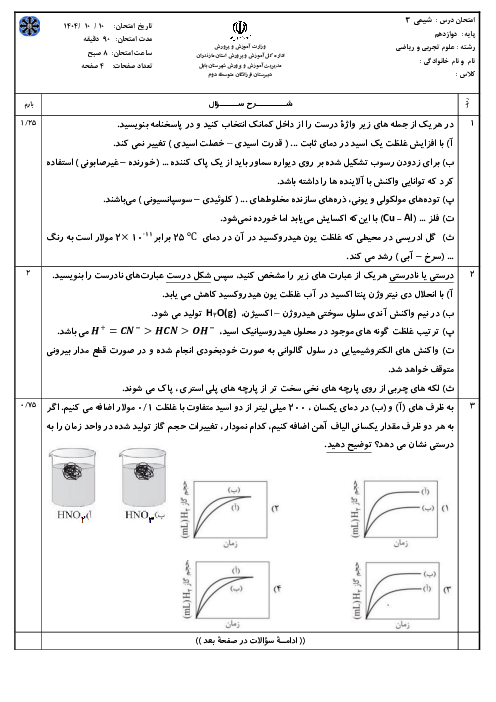
اگر از دو الکترود آهنی در یک سلول الکترولیتی برای برقکانت آب شهری استفاده شود، کدام عبارت درست است؟
$F{{e}^{2+}}+2{{e}^{-}}\rightleftharpoons Fe\left( s \right)\begin{matrix} {} & E{}^\circ \\ \end{matrix}=-0/44V$
${{O}_{2}}\left( g \right)+4{{H}^{+}}\left( aq \right)+4{{e}^ {-}}\rightleftharpoons 2{{H}_{2}}O\left( 1 \right)\begin{matrix} {} & E{}^\circ \\ \end{matrix}=+1/23V$
$2{{H}_{2}}O+2{{e}^{-}}\rightleftharpoons {{H}_{2}}\left( g \right)+2O{{H}^{-}}\left( aq \right)\begin{matrix} {} & E{}^\circ \\ \end{matrix}=+0/83V$
1 )
در آند، گاز هیدروژن آزاد میشود.
2 )
جرم گاز آزاد شده پیرامون هر دو قطب یکسان است.
با عبور جریان برق، مقداری آهن (II) هیدروکسید به وجود میآید.
4 )
واکنش کلی این سلول همانند واکنش الکترولیز آب با الکترود گرافیت است.