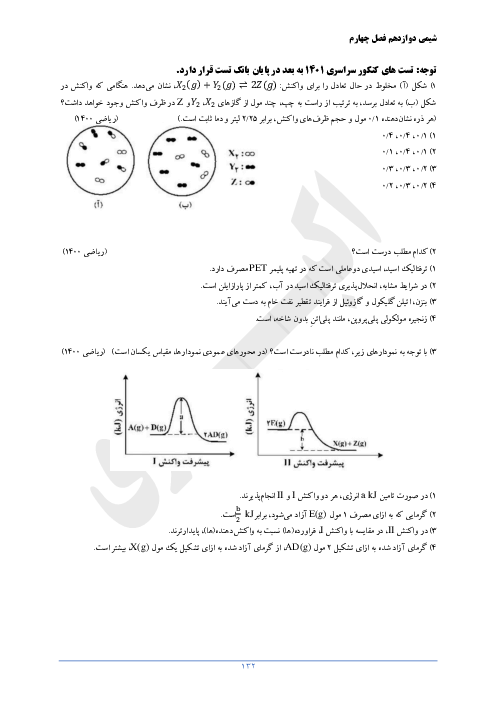
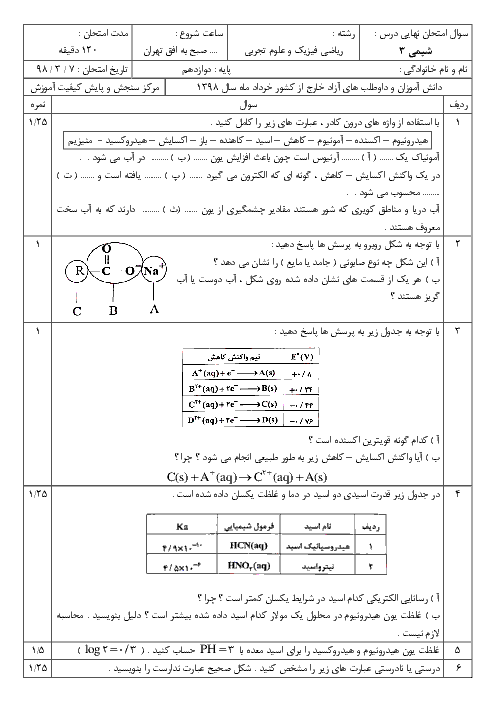
كدام مقايسه در مورد رسانايی الكتريكی محلول آبی اسيدهای زير صحيح است؟ (محلول هر چهار اسيد در شرايط يكسان از نظر دما و غلظت قرار دارند.)
1 )
${{H}_{2}}S{{O}_{4}}=HN{{O}_{3}}\gt HN{{O}_{2}}\gt HCN$
${{H}_{2}}S{{O}_{4}}\gt HN{{O}_{3}}\gt HN{{O}_{2}}\gt HCN$
3 )
${{H}_{2}}S{{O}_{4}}=HN{{O}_{3}}\gt HCN\gt HN{{O}_{2}}$
4 )
${{H}_{2}}S{{O}_{4}}\gt HN{{O}_{2}}\gt HN{{O}_{3}}\gt HCN$