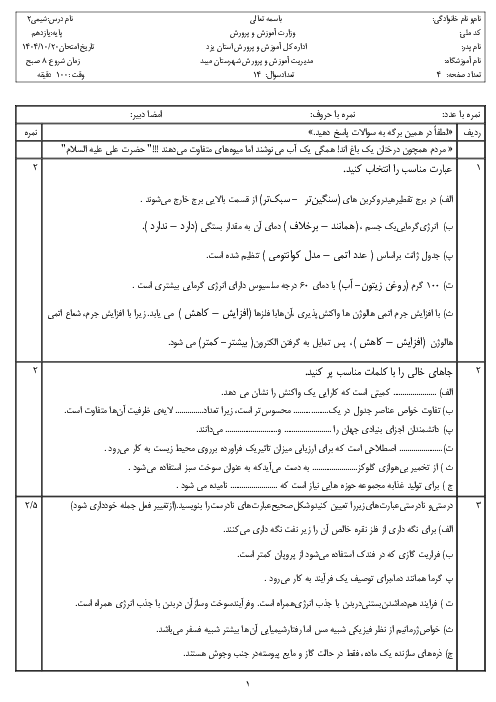
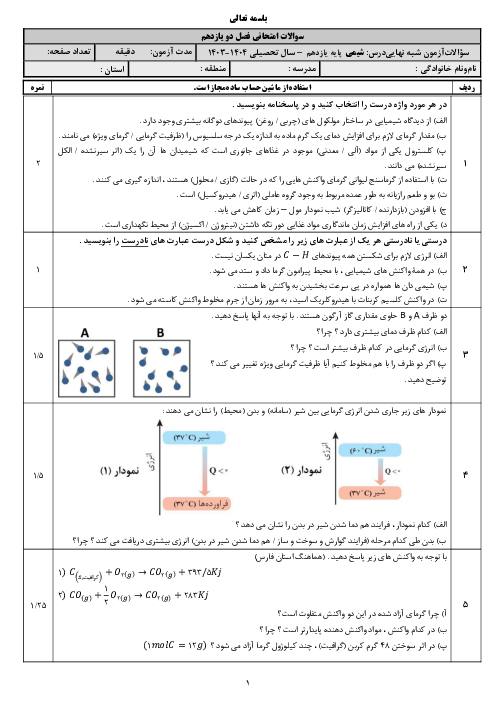
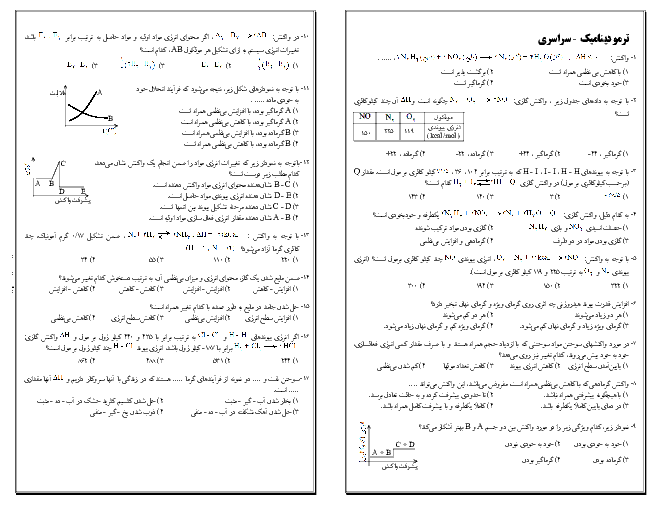
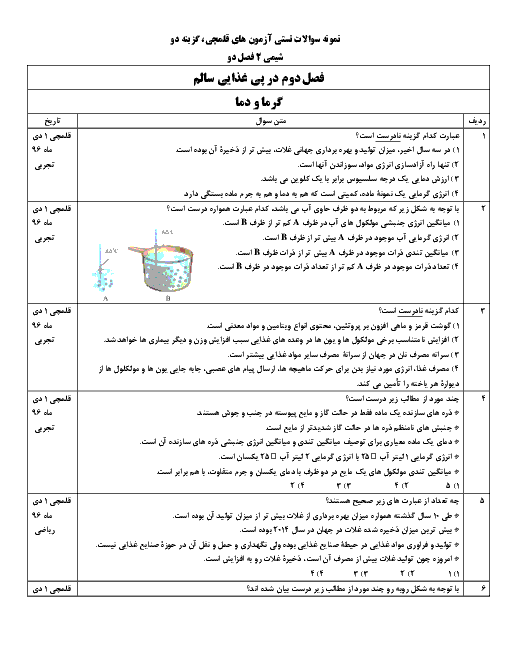
آزمون تستی آمادگی کنکور سراسری شیمی (2) یازدهم رشتۀ تجربی و ریاضی | فصل سوم: درس 1-3- مفاهیم اولیه تولید پوشاک
لطفا برای اطمینان از عملکرد و تجربه بهتر از مرورگرهای مدرن و به روز مانند کروم یا فایرفاکس استفاده کنید.

واکنش ترمیت برای جوش دادن خطوط راهآهن بهکار میرود. در این واکنش به ازای مصرف 90 گرم آلومینیوم تقریباً 1372 کیلوژول گرما آزاد میشود. $2Al(s) + F{e_2}{O_3}(s) \to A{l_2}{O_3}(s) + 2Fe(l)$
الف) $\Delta H$ این واکنش را برحسب کیلوژول حساب کنید. $(1molAl = 27g)$
ب) اگر این مقدار گرما (1372 کیلوژول) دمای 500 کیلوگرم از یک فلز را به اندازهٔ ${11/6^ \circ }C$ افزایش دهد، با محاسبه و با کمک جدول نشان دهید این فلز کدام است؟