واکنش ترمیت برای جوش دادن خطوط راهآهن بهکار میرود. در این واکنش به ازای مصرف 90 گرم آلومینیوم تقریباً 1372 کیلوژول گرما آزاد میشود. $2Al(s) + F{e_2}{O_3}(s) \to A{l_2}{O_3}(s) + 2Fe(l)$
الف) $\Delta H$ این واکنش را برحسب کیلوژول حساب کنید. $(1molAl = 27g)$
ب) اگر این مقدار گرما (1372 کیلوژول) دمای 500 کیلوگرم از یک فلز را به اندازهٔ ${11/6^ \circ }C$ افزایش دهد، با محاسبه و با کمک جدول نشان دهید این فلز کدام است؟
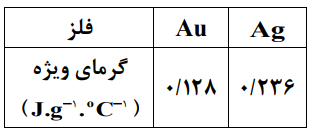
پاسخ تشریحی :
تحلیل ویدئویی تست
منتظریم اولین نفر تحلیلش کنه!